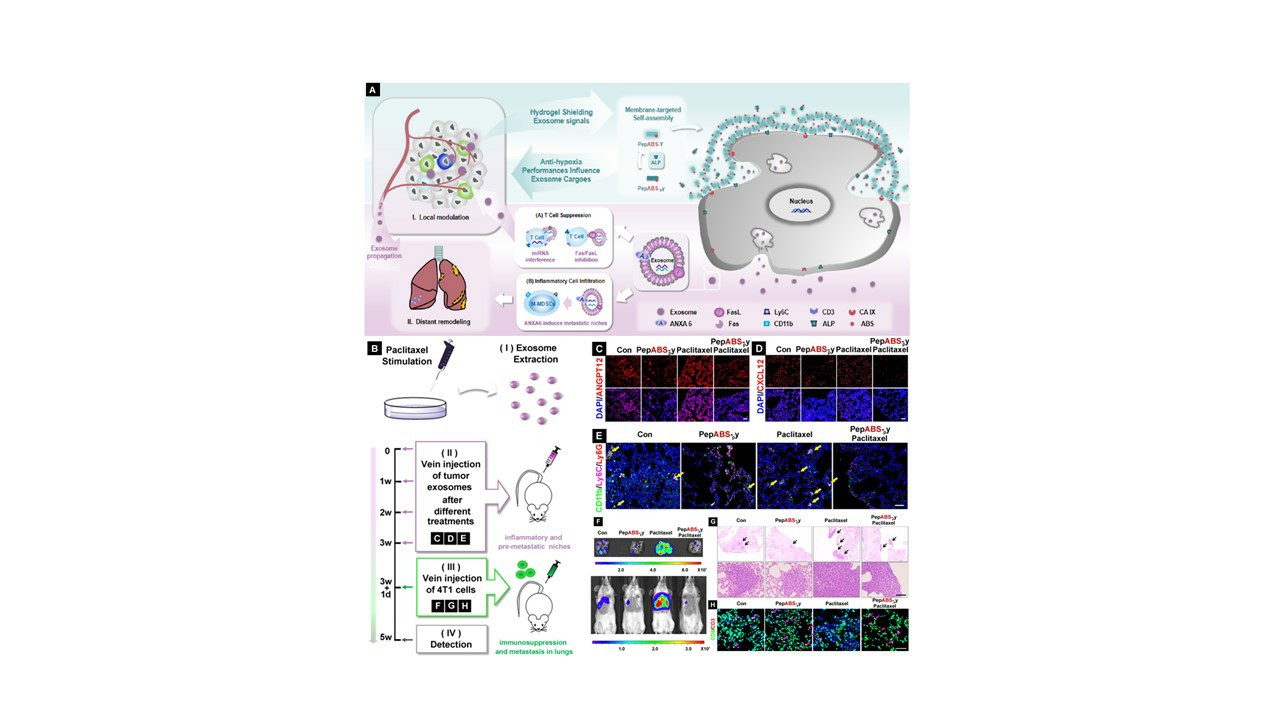
近日,《美国化学会·纳米》在线发表中国科学院院士、国家纳米科学中心研究员陈春英课题组在抗肿瘤纳米药物研究领域的最新成果。该团队首次在乏氧肿瘤细胞表面形成纳米纤维状水凝胶结构,抑制肿瘤外泌体扩散,同时携带一种酶(ca ix)抑制剂以缓解肿瘤低氧环境,最终增强免疫系统对肿瘤的杀伤能力,实现治疗过程中更高效的肿瘤微环境时空控制治疗策略。
 自组装水凝胶介导的外泌体通讯干扰。受访者供图
自组装水凝胶介导的外泌体通讯干扰。受访者供图
当前纳米技术为人们提供多种智能策略来对抗乏氧的肿瘤微环境。然而,如果不能有效通过切断肿瘤内部及远距离通信,任何治疗手段都有可能进一步刺激肿瘤外泌体释放免疫逃逸和转移信号。因此,实现肿瘤微环境全面改善的治疗方式仍有待探索与研究。
前期研究中,陈春英课题组与其合作团队在高效低毒抗肿瘤纳米药物的研制及作用机制研究方面已获得一系列进展。他们曾获得一种特异性杀伤乏氧肿瘤细胞的自组装短肽纳米纤维材料。该材料通过靶向乏氧肿瘤细胞膜上ca ix并发生自组装,特异性杀伤乏氧肿瘤细胞。
在此基础上,该团队设计出一种靶向肿瘤细胞膜的磷酸酶响应型短肽自组装分子。它能在肿瘤细胞膜表面形成水凝胶,有效捕捉并抑制肿瘤细胞释放的外泌体,阻止其在肿瘤微环境中的传播,以及对肿瘤免疫微环境的产生调节作用。在乏氧肿瘤微环境中,水凝胶对肿瘤外泌体中的微小rna表达产生了显著调控,特别是在t细胞信号传导过程中,增强了cd8 t细胞的增殖与浸润,改善了肿瘤内部的免疫抑制微环境,从而进一步减弱肿瘤在乏氧微环境下的适应能力。
值得关注的是,在与化疗药物联用时,该水凝胶材料能显著限制肿瘤细胞与其它器官之间的远距离交流,有效重塑远端肺组织中的免疫与炎性微环境,抑制化疗刺激诱导的肿瘤细胞转移风险。
“该研究展示了通过水凝胶阻断肿瘤外泌体通信,从而抑制肿瘤适应性的新策略。”陈春英说,“这不仅提升肿瘤内部抗肿瘤免疫效果,还对远端炎性转移环境改善有着不容忽视的作用,对逆转肿瘤营造的全身系统性环境至关重要,具有较强的临床应用潜力。”(来源:中国科学报 张双虎)
相关论文信息: