靶向蛋白降解(tpd)是当今生物医药领域的热门研究方向,通过tpd分子将疾病相关蛋白牵引至细胞内的“回收站”进行降解清除,为传统药物难以成药的蛋白质提供了巨大的治疗潜力。现有的tpd分子为适应不同的疾病靶点和器官特异性,通常需要复杂的分子设计和从头合成。研究团队意识到,生物相容性纳米颗粒(np)在药物递送领域已有广泛应用,并且已有多种临床药物成功进入市场,而纳米颗粒的多功能特性为tpd工具的开发提供了新的可能性。
2024年10月28日,河南大学郑蒙教授、冰洋教授和美国哥伦比亚大学梁锦荣教授合作在nature nanotechnology期刊报道了一种新的纳米生物学效应,文章题目为“targeted protein degradation via cellular trafficking of nanoparticles”。该研究团队发现抗体、多肽修饰的纳米颗粒在细胞运输过程中自发地会启动靶向蛋白降解,不需要特殊的细胞内吞和降解途径引导结构设计,基于此提出了一种基于纳米颗粒的靶向蛋白降解通用策略(tpd-nps),该策略不仅有望改变现有tpd工具的繁琐开发方式,还为纳米医学提供了新的知识,扩展了纳米药物的应用范畴。
论文通讯作者为河南大学郑蒙教授、冰洋教授和美国哥伦比亚大学梁锦荣教授,第一作者为刘洋博士和硕士研究生刘润涵。
在这项研究中,研究人员提出了一种通用策略,即使用工程化的纳米颗粒(np)设计和开发有效的tpd工具用于细胞外目的蛋白(poi)的降解。如图1,tpd-np可以由poi结合配体与dspe-peg连接臂结合并与plga核锚定形成。研究人员利用靶向膜蛋白egfr的单抗尼妥珠(nimotuzumab, ntz)偶联peg-dspe后与plga纳米颗粒组装制备了ntz-np,结果发现ntz-np能够有效促进膜蛋白egfr的降解。
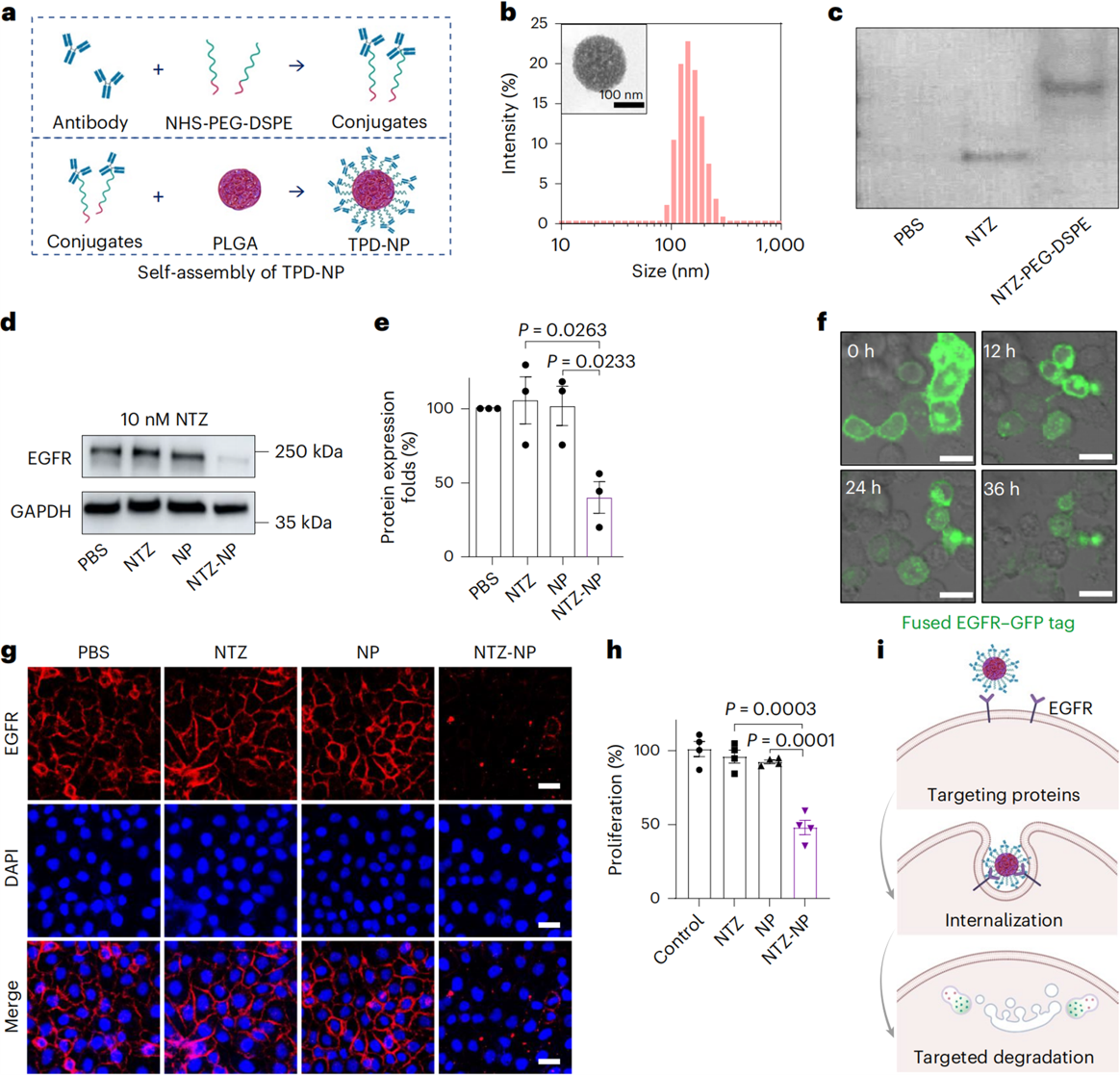
图1:抗体偶联生物可降解纳米颗粒(tpd-np)介导的egfr降解。
注:plga是一种常用的医用高分子材料;ntz指egfr靶向抗体尼妥珠单抗;peg-dspe一种常见的聚乙二醇-脂质。
该研究发现这一现象具有普遍性,适用多种靶点和不同的纳米颗粒形式,因此tpd-np策略具有广泛的应用潜力(图2)。tpd-np系统可干预的靶蛋白种类众多,已测试的靶点包括肿瘤免疫逃逸靶点pd-1/pd-l1以及肿瘤标志物如egfr和her2等。此外,tpd-np的“靶头”设计灵活多变,除了抗体,还可通过多肽等多种方式结合目标蛋白,如针对新冠病毒sars-cov-2的关键细胞受体ace2和流感病毒受体及肿瘤表面标志物cd13等。
在纳米颗粒的选择上,tpd-np同样展现出极高的灵活性。脂质体、外泌体、仿生纳米颗粒和无机纳米颗粒等多种类型的纳米载体均可被用于构建tpd-np系统。这种多样性使得tpd-np系统能够根据不同的治疗需求进行组合与优化,轻松构建出各种高效的靶向蛋白降解工具。例如,研究团队已成功开发出可同时降解多个靶点的tpd-np系统,并设计了具有特定组织靶向能力的tpd-np系统。
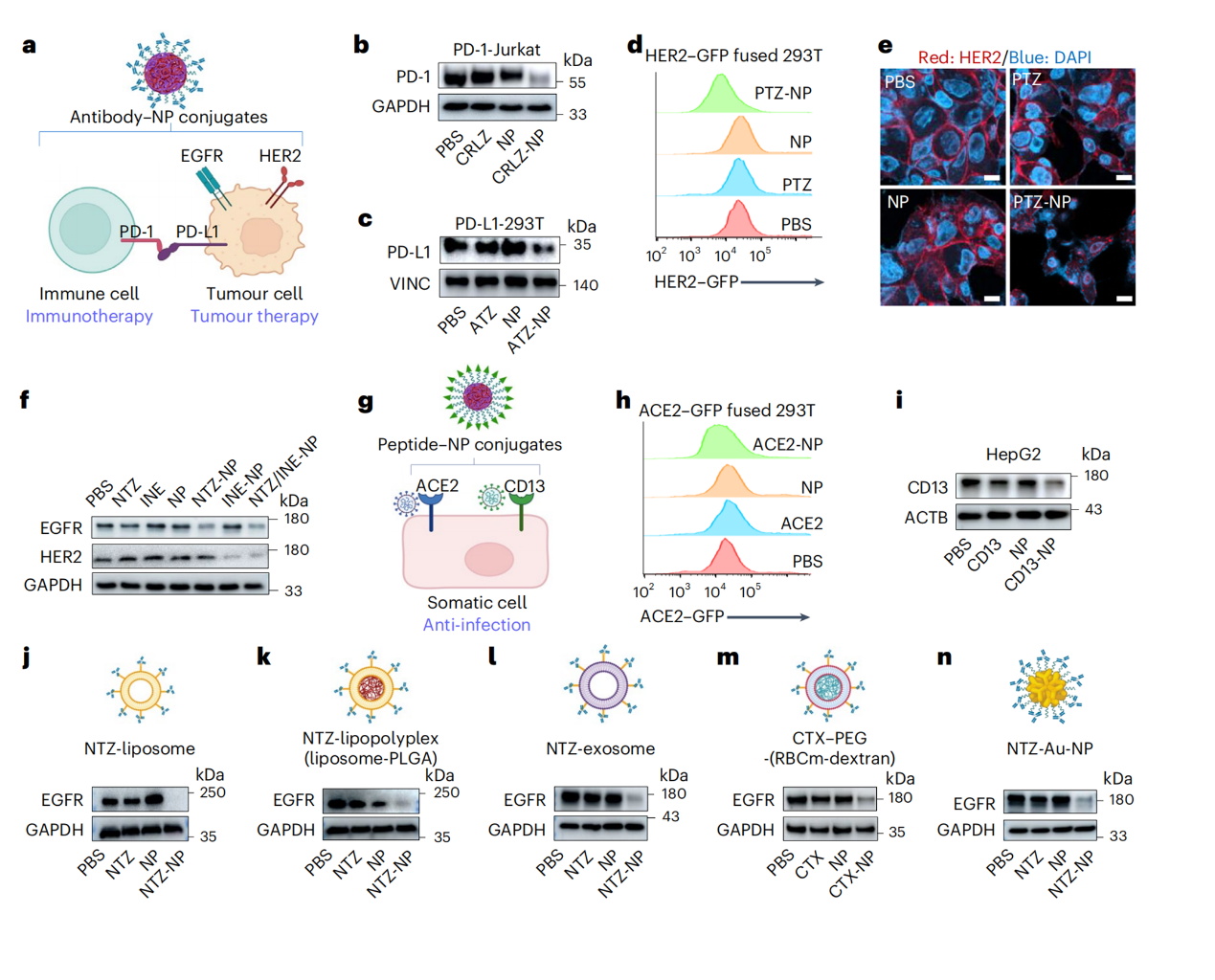
图2:tpd-np在不同疾病靶点的广谱性和设计中的灵活性。
注:crlz指pd-1靶向抗体camrelizumab;atz指pd-l1靶向抗体atezolizumab;ptz和ine指her2靶向抗体pertuzumab和inetetamab;ace2和cd13代表各自的结合肽;ctx指egfr靶向抗体cetuximab;rbcm表示红细胞膜;dextran是一种常用的医用材料;au-np代表金纳米粒子。
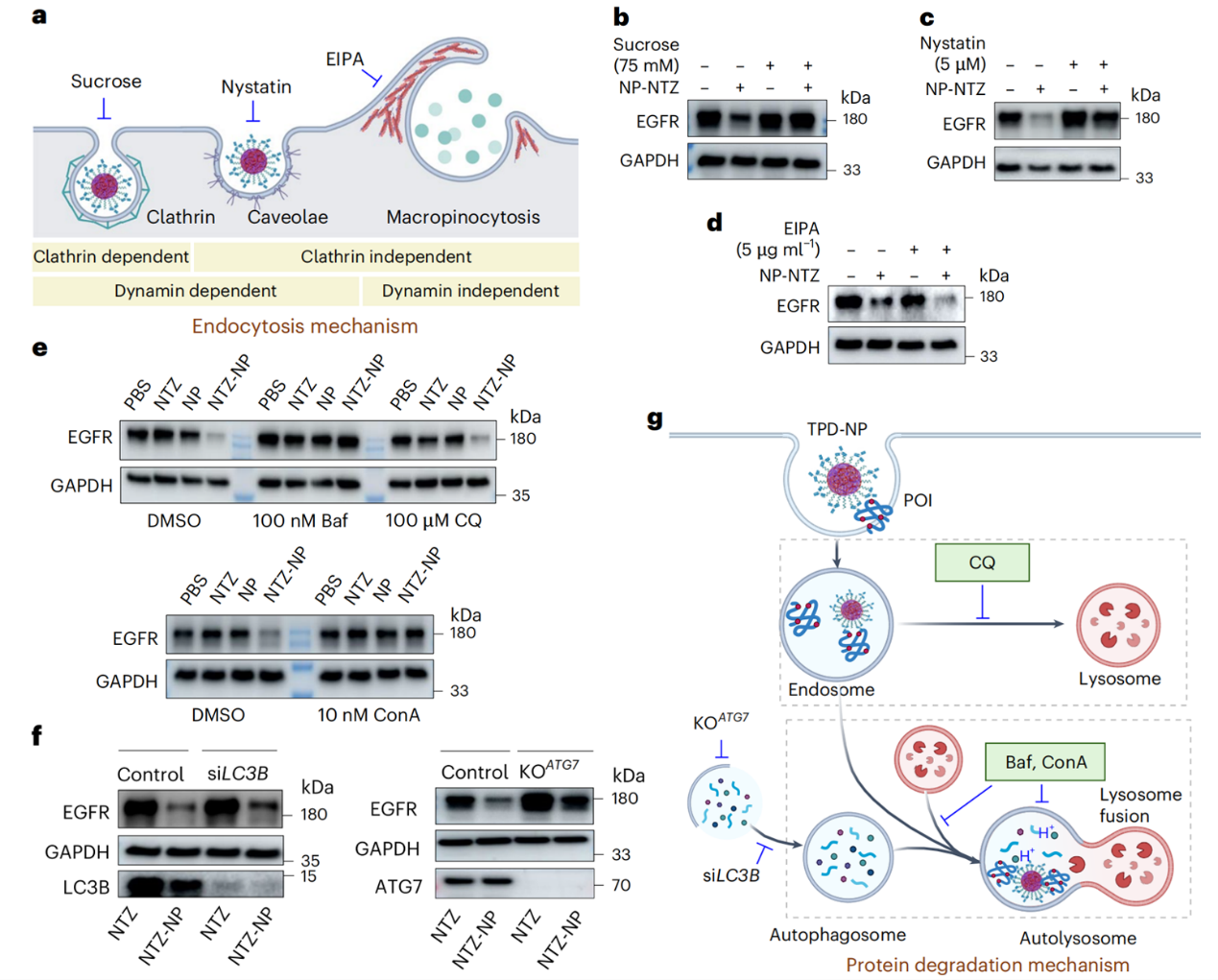
图3:tpd-np的内吞-降解作用机制。
该研究还深入探讨了tpd-np实现靶向蛋白降解的具体机制(图3)。tpd-np主要通过网格蛋白和小窝蛋白介导的内吞途径进入细胞,而非依赖巨胞饮机制。进入细胞后,tpd-np通过自噬溶酶体途径降解目标蛋白,而非蛋白酶体途径。为了验证tpd-np的实际效果,研究团队在人三阴性乳腺癌和人胶质瘤的小鼠模型中进行了实验(图4)。结果显示,经改良的tpd-np能够成功在小鼠体内降解肿瘤中的关键蛋白,从而有效抑制肿瘤生长并显著延长小鼠的生存期。这些结果表明,tpd-np具备通过“即插即用”方式实现个性化治疗的巨大潜力。

图4:tpd-np系统在人乳腺癌和人胶质瘤动物模型的体内效果验证。a, b, c, d. ntz-np对皮下乳腺癌模型小鼠的治疗;e. ntz-np对小鼠的肝肾负担评价;f, g, h. ntz-np对脑胶质瘤小鼠的治疗。
总的来说,该研究揭示了一种纳米颗粒降解靶蛋白的新的纳米生物学效应,为纳米药物的设计与开发提供了全新的基础性知识与方向。该研究也提出了一个更广泛的靶向蛋白降解平台,同时推动了药物纳米递送和tpd技术的发展。未来,随着研究的深入与技术的不断成熟,tpd-np有望在多种疾病治疗中发挥更加重要的作用。(来源:科学网)
相关论文信息: