铁死亡是一种铁依赖性的、非凋亡性、程序性细胞死亡,因其独特的机制在肿瘤治疗和神经退行性疾病领域引起广泛关注。近日,中国科学院杭州医学研究所(以下简称杭州医学所)研究员覃江江课题组、程向东教授团队联合研发了一款小分子降解药物,该药物可触发癌细胞铁死亡。相关成果于9月4日发表在药物化学领域权威期刊《药物化学杂志》(journal of medicinal chemistry)上。
论文图文摘要。杭州医学所 供图
覃江江课题组长期致力于铁死亡调控肿瘤转移与免疫逃逸的分子机制及新药研发。2024年,该课题组与程向东团队和美国德克萨斯大学md安德森癌症中心教授王凌华团队合作,构建了晚期胃腺癌的单细胞多组学图谱,并在此基础上分析发现,胃腺癌在进展过程中能通过上调调控铁死亡抵抗的关键酶gpx4来逃避癌细胞铁死亡,促进疾病进展与转移。据此合作团队发现,抑制gpx4或其它相关通路诱导铁死亡可显著缓解肿瘤生长和转移,并增强免疫治疗疗效。
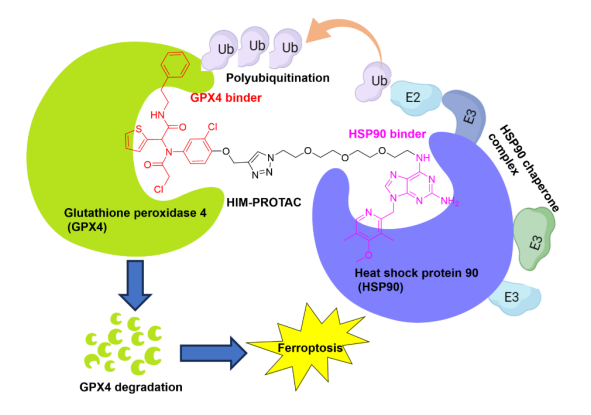
gpx4是调控铁死亡抵抗的关键酶且在肿瘤中高表达,是抗肿瘤药物开发的有效靶点。覃江江课题组前期开发了靶向gpx4的小分子抑制剂,但因gpx4的结合口袋较浅,这些小分子抑制剂均在药代动力学和选择性等方面存在局限性。
与传统小分子抑制剂占位驱动不同,以事件驱动为基础的靶向蛋白质降解 (tpd) 代表了一种新兴的治疗策略。目前已报道的靶向蛋白降解剂protac可实现选择性降解 gpx4。然而,现有protac技术因主要集中招募crbn或vhl e3泛素酶而面临脱靶效应和耐药性等问题。
为解决脱靶和耐药性问题,覃江江课题组联合程向东团队设计开发了基于热休克蛋白90(hsp90)分子伴侣复合物的蛋白质降解剂,其可通过降解内源性gpx4触发癌细胞铁死亡。
据介绍,hsp90是一种分子伴侣,广泛表达于肿瘤中,其可通过招募多种e3泛素连接酶复合物促进蛋白质降解,有望成为新型靶向蛋白质降解的策略。
联合团队发表的论文展示了一种通过招募肿瘤中过表达的hsp90及其复合物实现蛋白质降解的创新策略,为解决传统protac耐药或者在vhl或crbn内源性低表达或者突变的细胞系提供了潜在的手段。覃江江表示,尽管降解过程中涉及的e3连接酶机制尚不完全明确,但该研究仍为基于伴侣的tpd策略提供了新的方向。(来源:中国科学报 赵广立)
相关论文信息: