在胶质母细胞瘤(gbm)患者中,上调的生长因子midkine(mdk)诱导替莫唑胺(tmz)耐药性。美国康奈尔大学生物医学工程系赵宇博士与哈医大二院神经外科蔡金全团队报道了一种聚合物锁定膜融合脂质体(plofsome),可穿过血脑屏障(bbb)并将sirna或crispr-cas9递送至gbm细胞胞质,下调mdk表达并降低tmz耐药。plofsome利用无痕活性氧(ros)可降解连接子,将聚合物“锁”整合至融合脂质体表面,使其仅在穿过bbb并进入高ros水平的gbm组织后发生融合,从而特异性地在肿瘤部位发挥作用,提高rnai和crispr-cas9疗法的安全性。
相关成果“polymer-locking fusogenic liposomes for glioblastoma-targeted sirna delivery and crispr-cas gene editing”发表在2024年8月29日的nature nanotechnology期刊上。论文通讯作者是蔡金全、蒋传路、孟祥祺、赵宇,第一作者是赵宇、秦杰。
gbm是最致命的中枢神经系统癌症之一,重要原因在于其对临床治疗的耐药性难以克服。gbm中mdk的表达上调加速了对化疗药物tmz引起的dna损伤修复。虽然rnai和crispr-cas9基因编辑技术是降低mdk表达的有效方法,但它们的递送仍具有挑战性。其原因在于,通过静脉(i.v.)注射递送sirna或crispr-cas9 rnp复合物需要经过一个复杂的三步过程:这些生物制剂需(i)通过内吞途径进入靶细胞;(ii)从内涵体或溶酶体内逃逸至细胞质;(iii)从载体中释放。然而,在步骤(ii)中,生物制剂从内涵-溶酶体逃逸的效率非常低(不足2%),且脑内递送仍需克服如bbb等多重生理障碍。
作者报道了一种新型聚合物锁定融合脂质体(plofsome),能够穿过bbb并将sirna和crispr/cas9 rnp递送至gbm细胞胞质中。plofsome通过将四臂聚乙二醇-邻二酚(4-arm peg-odp)锚定到angiopep-2修饰的融合脂质体表面而制成。由于gbm组织中ros水平较高,因此选择了可降解的ros连接子来锚定4-arm peg-odp。angiopep-2是低密度脂蛋白受体相关蛋白1(lrp-1)的特异性配体,该受体在bbb内皮细胞和gbm细胞中高度表达。融合脂质体因其卓越的胞质递药能力成为plofsome核心结构,此类脂质体使药物内化和释放同时发生,大幅简化了递送步骤且避免了内涵-溶酶体途径导致的药物降解。然而,常规融合脂质体在脑靶向递送中存在缺陷,通常会在穿过bbb时结构崩解,导致颅内gbm细胞对药物的摄取效率低下。为解决这一问题,作者在融合脂质体表面整合了聚合物锁链结构,使其仅在穿过bbb并进入gbm组织后才与肿瘤细胞发生融合。
plofsome在血液循环和穿过bbb期间保持非融合状态,一旦进入大脑,plofsome受肿瘤组织中过表达的ros(如过氧化氢h2o2)刺激,4-arm peg-odp随即从载体表面分离,使plofsome具备融合能力。其工作原理类似于被解锁后的保险箱一样,plofsome仅在高h2o2环境中与靶细胞融合并释放其所负载的药物。具体实验结果表明,plofsome能有效将simdk或crispr-cas9 rnp递送至gbm细胞胞质,抑制mdk表达,从而降低tmz耐药性,并在原位脑肿瘤模型中显著抑制gbm生长。值得注意的是,plofsome仅在肿瘤部位有效,而对正常脑组织及其肝肾组织无影响。
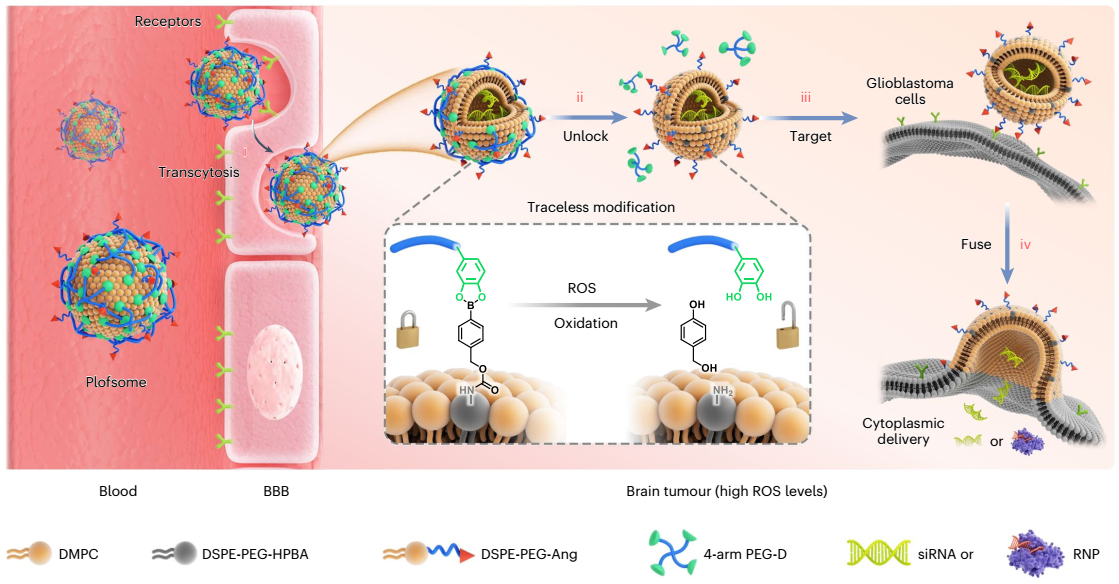
图1:plofsome用于针对胶质母细胞瘤的sirna递送和crispr/cas基因编辑。
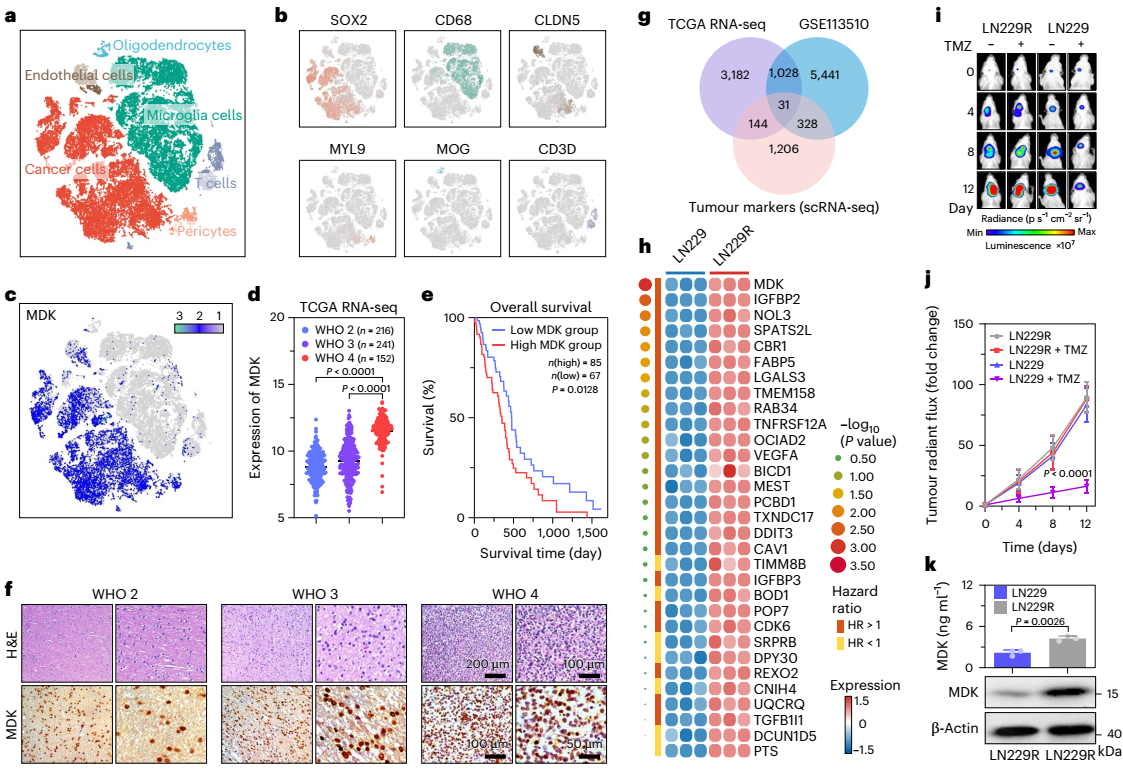
图2:mdk促进tmz耐药性和gbm细胞恶性进展。
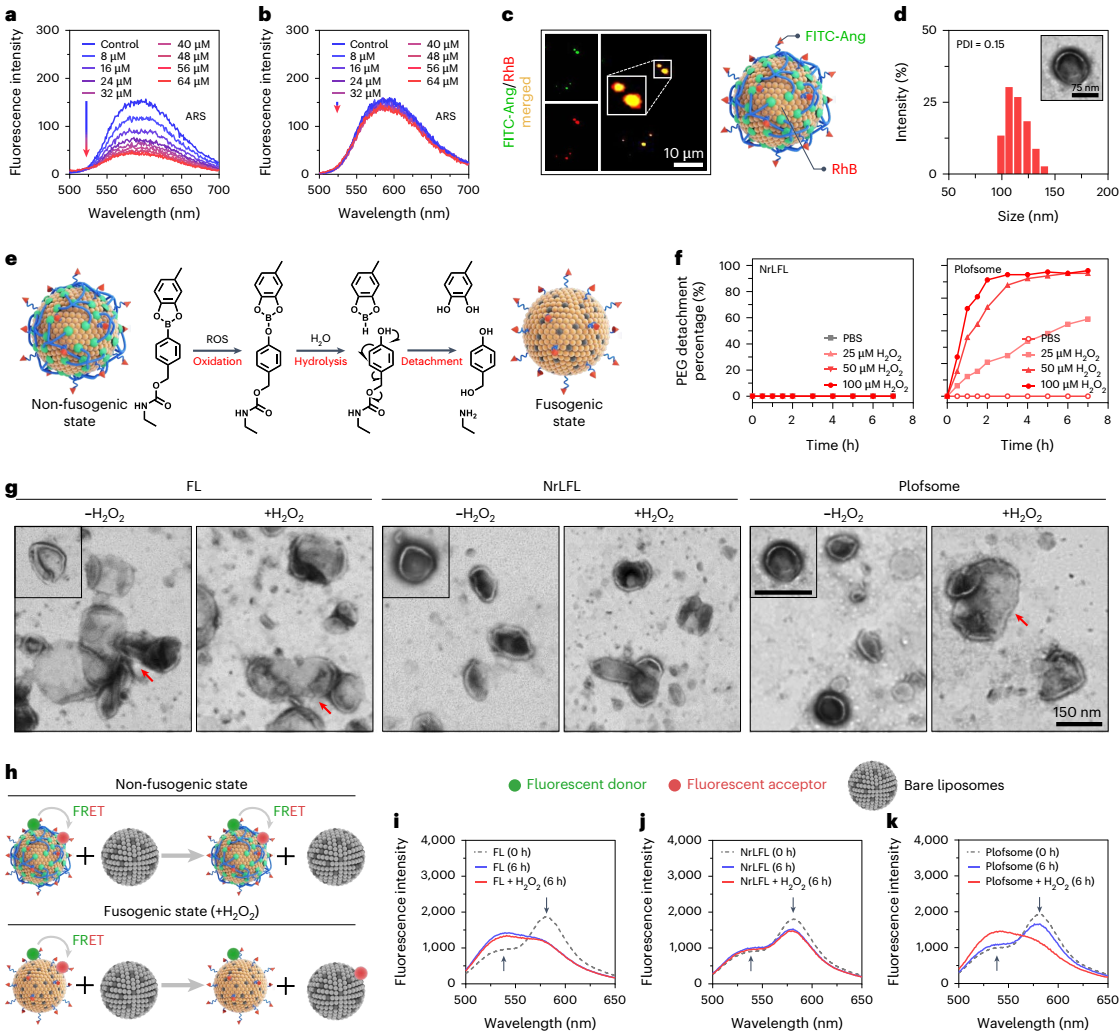
图3:plofsome的可控膜融合特性。
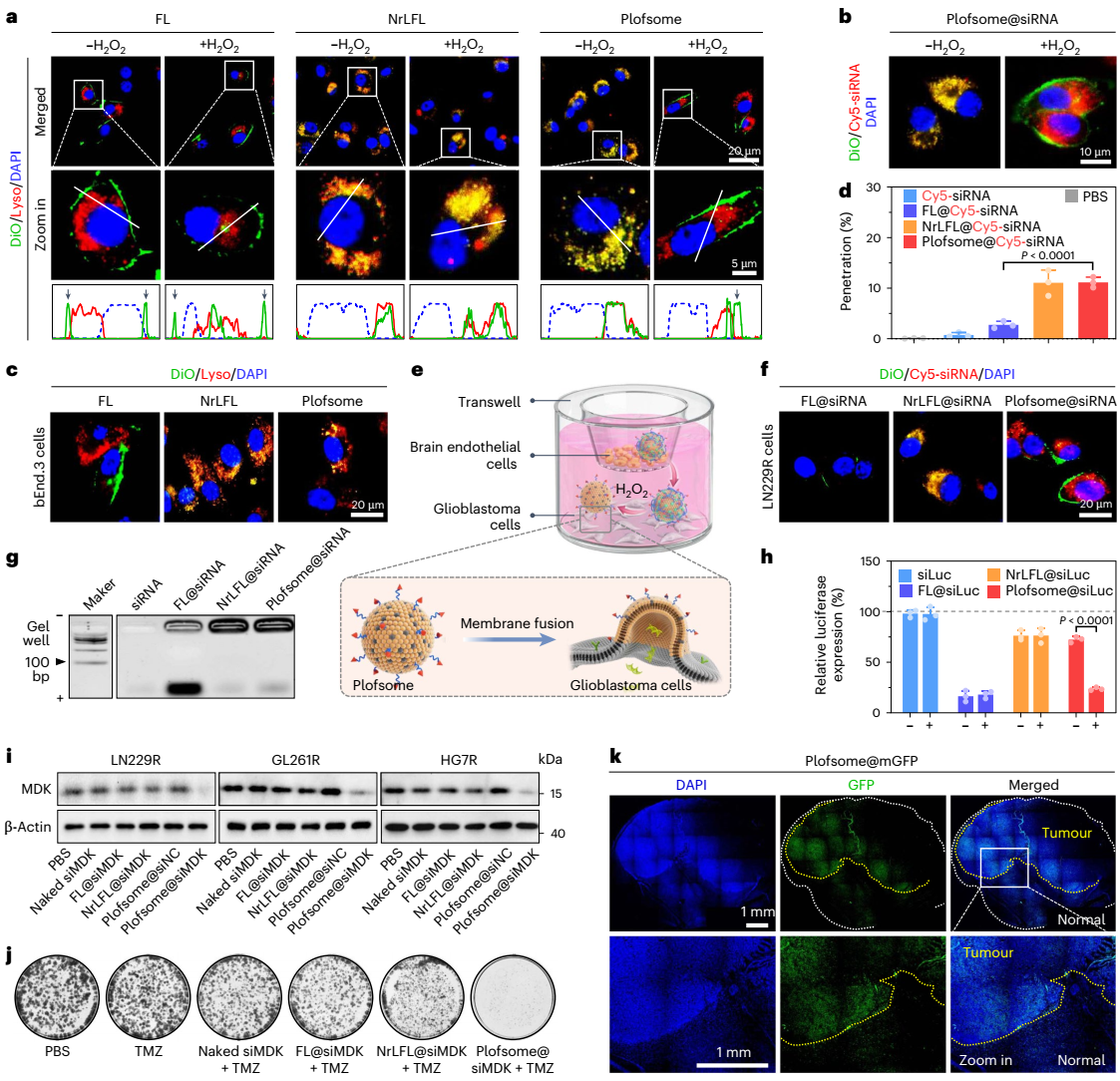
图4:plofsome在ros高水平下与靶细胞融合以促进sirna的胞质递送。
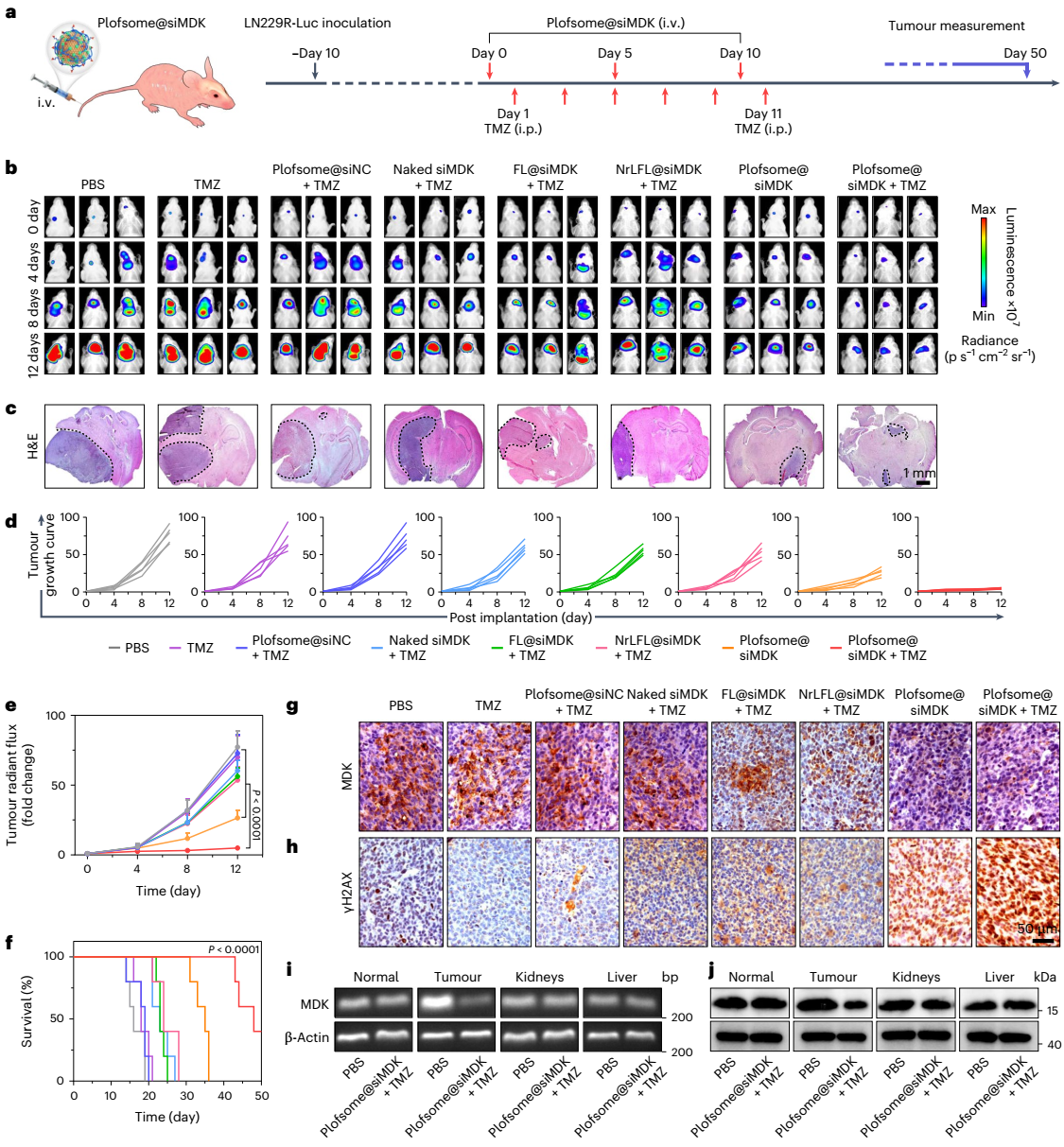
图5:plofsome@simdk在原位ln229r-luc肿瘤小鼠模型中的抗肿瘤功效。
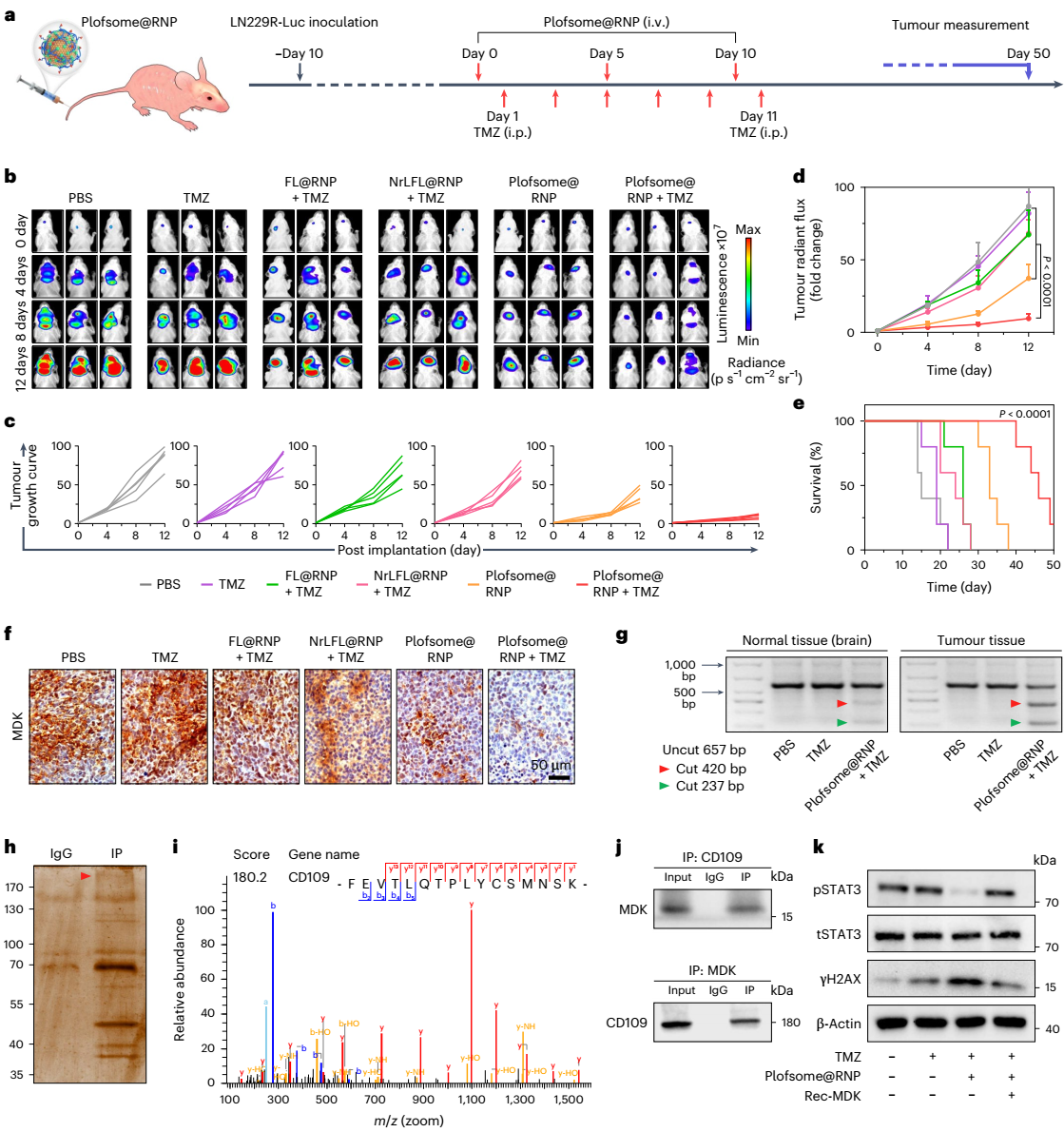
图6:plofsome@rnp在原位ln229r-luc肿瘤小鼠模型中的抗肿瘤功效。
(来源:科学网)
相关论文信息: