|
|
|
|
|
qb 量子力学/分子力学和分子动力学揭示的三磷酸腺苷-胰岛素降解酶间的静电相互作用 |
|
|
论文标题:
期刊:
作者:sarawoot somin, don kulasiri, sandhya samarasinghe
发表时间:12 august 2024
doi:
微信链接:
阿尔茨海默病(ad)已成为威胁人类健康的慢性疾病之一。为了预防或减缓ad,必须在其早期进行治疗和药物干预。许多研究表明,淀粉样β肽(aβ肽)在ad的发展中起着重要作用,它们是大脑正常代谢淀粉前体蛋白的产物,其异常聚集会阻碍突触中的神经递质传递,从而引起神经退行性疾病。胰岛素降解酶(ide)可以帮助降解aβ肽并促进aβ清除。但在ad早期阶段,ide可能会被损失,从而导致aβ肽的聚集,加速ad进展。而三磷酸腺苷(atp)在aβ清除中充当ide的负调节因子。atp与ide的相互作用会导致后者的构象发生变化,从而降低aβ清除的活性。为了抑制atp相互作用,ad药理学干预的药物设计需要在分子和量子水平上深入了解atp-ide相互作用。
近日,来自新西兰林肯大学的don kulasiri团队在quantitative biology期刊上发表了一篇题为“on electrostatic interactions of adenosine triphosphate–insulin-degrading enzyme revealed by quantum mechanics/molecular mechanics and molecular dynamics”的文章,文章成功采用量子力学/分子力学(qm/mm)计算模型,探索了atp和ide之间的静电相互作用,并在不同温度下进行分子对接(md)模拟,识别ide的灵敏性和热稳定性。本文提出的一种使用qm/mm和md混合的计算模型,可以在分子和量子水平上探索atp和ide之间的关系。

全文概要
本文提出了一种使用qm/mm和md混合的计算模型,在分子和量子水平上探索atp和ide之间的关系(图1)。
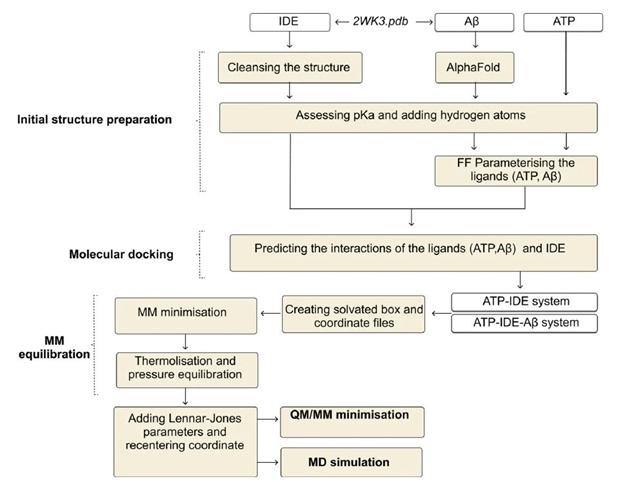
图1. 计算模型框架
作者首先进行了10个atp构象的分子对接,并基于经典力场能量计算,选择了与ide结合自由能最低的构象,为后续的qm/mm最小化和md模拟准备了初始结构。随后作者通过qm/mm最小化,生成了atp与ide相互作用的构象,揭示了atp与ide之间的静电相互作用,包括氢键和静电吸引相互作用。
作者利用hirshfeld表面方法分析了atp与ide残基之间的邻近性,发现asp385和lys530残基与atp的邻近性最高,表明它们可能在atp与ide的相互作用中起关键作用。通过mopro软件包计算了相互作用的拓扑性质和能量,发现atp与ide残基之间的强相互作用具有部分共价键的特征。使用均方根波动(rmsf)值来表征ide残基在不同温度下的局部变化,发现ser576和lys858残基区域在热休克温度下可能是热敏感区域,而asp385、glu387、lys530和lys532残基区域在热休克温度下可能是热稳定区域。
以上结果表明, aβ肽与ide的活性位点结合可能会影响atp与ide在变构位点的亲和力和稳定性。尽管aβ肽的结合导致ide结合域的许多残基失去了与atp的静电相互作用,但asp385和lys530残基由于其高亲和力而保持稳定。此外,asp385、glu387、lys530和lys532残基在热休克温度下也表现出热稳定性,而ser576和lys585残基区域则是热稳定性受损的区域。这些发现为药物设计提供了深入的理解,有助于开发ide的变构激活剂/抑制剂。
qb期刊介绍
quantitative biology (qb)期刊是由清华大学、北京大学、高教出版社联合创办的全英文学术期刊。qb主要刊登生物信息学、计算生物学、系统生物学、理论生物学和合成生物学的最新研究成果和前沿进展,并为生命科学与计算机、数学、物理等交叉研究领域打造一个学术水平高、可读性强、具有全球影响力的交叉学科期刊品牌。
《前沿》系列英文学术期刊
由教育部主管、高等教育出版社主办的《前沿》(frontiers)系列英文学术期刊,于2006年正式创刊,以网络版和印刷版向全球发行。系列期刊包括基础科学、生命科学、工程技术和人文社会科学四个主题,是我国覆盖学科最广泛的英文学术期刊群,其中12种被sci收录,其他也被a&hci、ei、medline或相应学科国际权威检索系统收录,具有一定的国际学术影响力。系列期刊采用在线优先出版方式,保证文章以最快速度发表。
中国学术前沿期刊网

特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负米乐app官网下载的版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。