|
|
|
|
|
生命科学学院邓诣群教授团队揭示upf3b与ire1α互作调节细胞内质网应激的新机制 |
|
|
近日,生命科学学院邓诣群教授团队在生物学一区top期刊《cell death & disease》在线发表题为“upf3b modulates endoplasmic reticulum stress through interaction with inositol-requiring enzyme-1α”的研究论文,该研究发现upf3b与ire1α互作抑制细胞内质网应激,揭示了无义介导的mrna衰变(nmd)在细胞应激响应中的新型调控机制。

细胞在毒素、药物和缺氧等应激因素刺激下,会通过多种响应外界变化的应激型适应性模式,改变细胞内稳态,调节自身的存活或死亡,以适应外界压力。内质网应激是一种重要的细胞应激方式,通过诱导未折叠蛋白反应(upr)以缓解应激状态,维系细胞内稳态。ire1是重要的内质网应激传感器。nmd可以快速降解含有提前终止密码子的mrna,在mrna质量控制中发挥重要作用。nmd可以控制激活upr所必需的细胞应激阈值,nmd本底活性可调节细胞应激反应,维持细胞稳态。然而,nmd在维持内质网稳态中的作用尚不清楚。
作者前期发现呕吐毒素(don)等外界刺激作用细胞时,会明显抑制nmd因子upf3的功能,敲降upf3b的细胞系对don更敏感。此外,upf3b可特异性调节ire1α信号通路,这提示在don等毒素应激条件下,upf3b与ire1α可能存在密切关联。本研究中,作者发现upf3b与ire1α存在互作关系,bip与upf3b共同控制ire1α的激活。在生理条件下,upf3b通过与ire1α激酶结构域相互作用,抑制ire1α的活化,影响其磷酸化和寡聚化。
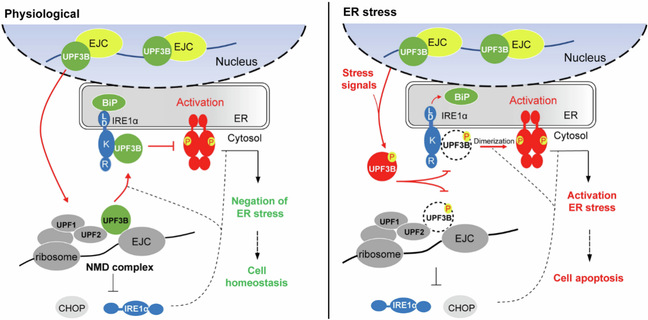
upf3b在nmd和内质网应激中的双重作用模式图
此外,nmd还可以通过调控ire1α和chop的表达来抑制内质网应激,并通过负反馈内质网应激重塑细胞稳态。在内质网应激过程中,upf3b磷酸化并与ire1α解离,丧失了对内质网应激的调节功能,促进ire1α和chop的表达,导致细胞凋亡。本研究首次为upf3b在nmd和内质网应激中的双重作用提供了证据,揭示nmd在调节细胞内质网稳态中的重要生理意义,同时也为don毒理机制提供了新的视角。
生命科学学院博士生孙兴盛为本文的第一作者,邓诣群教授和文继开教授为共同通讯作者。该研究得到国家自然科学基金项目、广东省基础与应用基金项目的资助。
论文链接:
文图/生命科学学院
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负米乐app官网下载的版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。