近日,浙江大学药学院、金华研究院和先进药物递释系统全国重点实验室的顾臻教授和王金强研究员团队研发出一种可口服的糖响应胰岛素制剂,可在胃肠道中保护负载的胰岛素,减少其突释及降解,增强吸收,并在肝脏形成血糖响应的胰岛素储库,智能调控胰岛素的释放。2024年9月2日,该研究成果以“an orally administered glucose-responsive polymeric complex for high-efficiency and safe delivery of insulin in mice and pigs”为题,发表在nature nanotechnology期刊上,第一作者是浙江大学药学院博士研究生季康凡。
糖尿病影响着全球超5亿人的生命健康。其中,超过20%的糖尿病患者需要外源性胰岛素治疗。然而,现有的胰岛素制剂通常经皮下注射给药,吸收后进入外周血液循环。胰岛素的治疗指数窄,导致胰岛素给药后患者低血糖频发,严重时会危及生命。而健康胰腺中的β细胞能感应血糖水平,精准智能调控胰岛素分泌。其分泌的胰岛素先经肝门静脉进入肝脏,发挥核心降糖作用,随后分布至外周,使得人体能够高效安全地控制血糖水平。因此,模拟人体胰岛素分泌机制,改变胰岛素给药方式,优化其外周起效的特点,对于胰岛素治疗具有重要意义。
近日,浙江大学药学院、金华研究院和先进药物递释系统全国重点实验室的顾臻教授和王金强研究员团队研发出一种可口服的糖响应胰岛素制剂,可在胃肠道中保护负载的胰岛素,减少其突释及降解,增强吸收,并在肝脏形成血糖响应的胰岛素储库,智能调控胰岛素的释放(图1)。在1型糖尿病小鼠和猪模型中,该制剂均可实现一天的血糖控制效果,且无低血糖症状发生。
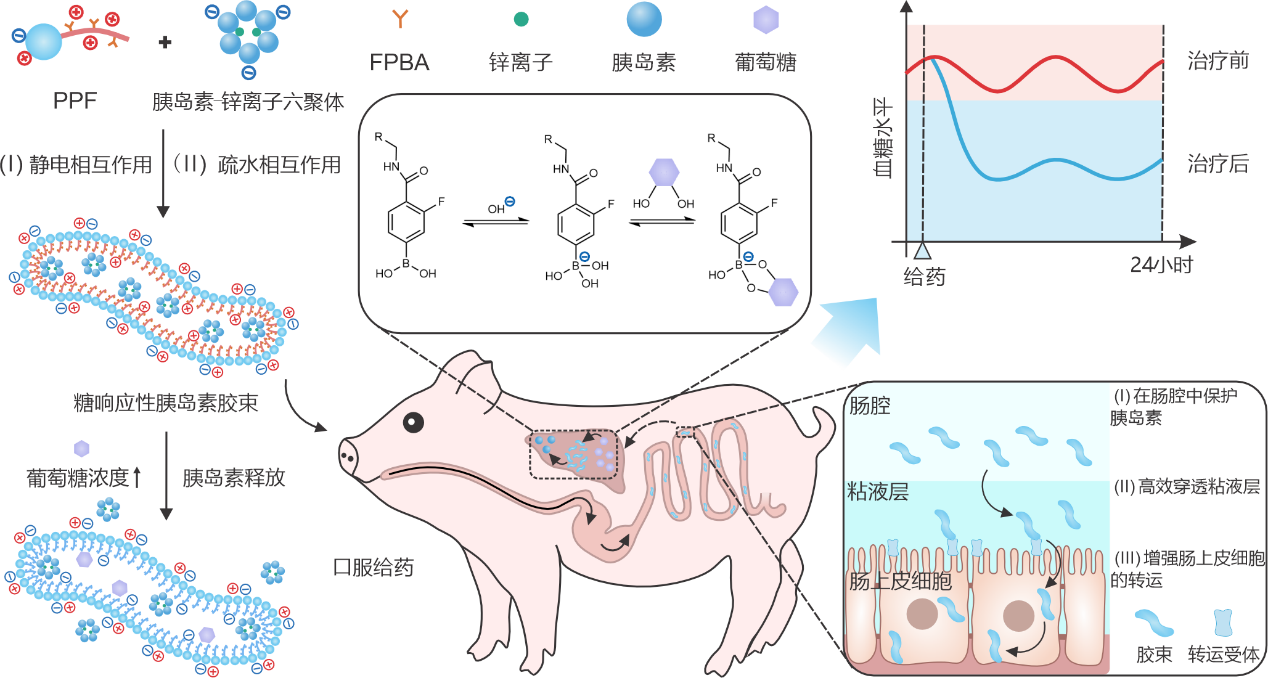
图1:糖响应性胰岛素胶束制剂的形成及糖响应释放胰岛素示意图。
该研究中,团队合成了一种两亲性聚合物(命名为ppf),其亲水端为两性离子型聚甜菜碱,疏水端为4-羧基-3-氟苯硼酸(fpba)修饰的聚2-氨基乙基甲基丙烯酸酯。胶束制剂由ppf与胰岛素-锌离子六聚体自组装形成。其独特的蠕虫状结构、较小的粒径以及两性离子表面,促进胰岛素在肠道内高效吸收,并在肝脏形成糖响应的胰岛素储库。
在正常血糖条件下,制剂中的胰岛素缓慢释放,有效维持基础血糖的稳定。而在高血糖状态下,葡萄糖会与fpba结合形成苯硼酸酯键,降低聚合物疏水端的正电荷密度及疏水性,刺激胰岛素快速释放。实验结果表明,在向小鼠灌胃荧光标记的胶束后,可于小鼠腹部及肝脏区域清晰观察到荧光分布。该制剂首先将胰岛素释放至肝脏组织,形成从肝脏到外周组织逐渐降低的浓度梯度,因此可显著减少低血糖事件的发生。
在糖尿病小鼠的葡萄糖耐量实验中,葡萄糖注射导致口服制剂组小鼠血糖升高,并使得小鼠血浆胰岛素浓度增加至初始值的2.6倍(图2a,b)。健康小鼠和糖尿病小鼠的血糖钳夹实验结果表明,口服制剂组的输糖速率分别是对应甘精胰岛素组速率的6%和60%(图2c)。这10倍的输糖速率提示,口服制剂组小鼠具有比甘精胰岛素组小鼠更高的血糖水平依赖性血糖清除能力。
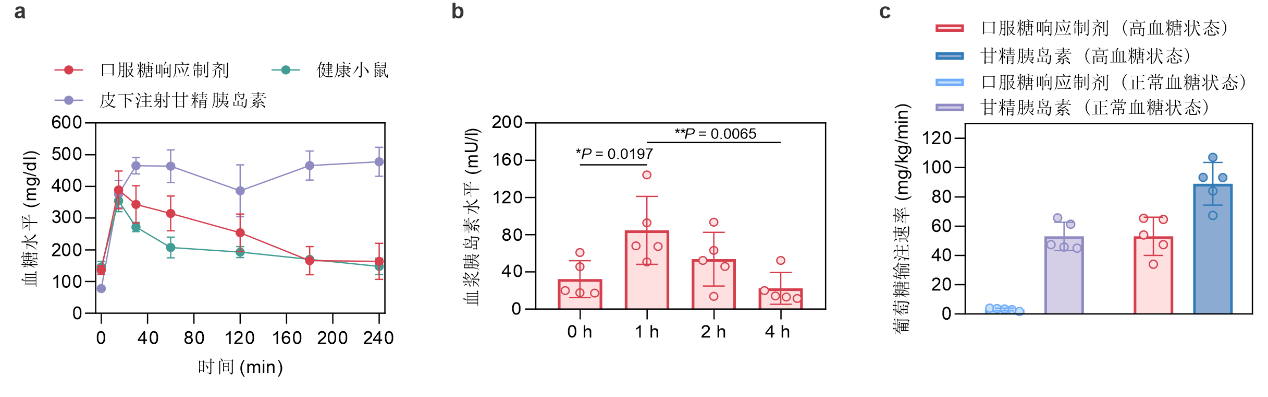
图2:a, b,糖尿病小鼠在葡萄糖耐量实验中的血糖变化和血浆胰岛素水平变化情况。c,小鼠血糖钳夹实验中,不同给药组别所需的葡萄糖输注速率。
在自发1型糖尿病小鼠模型中,连续七日口服该剂型,可以有效控制小鼠血糖(图3a)。在化学诱导的1型糖尿病小猪模型中,每日一次饲喂胶束胶囊,同样能够有效控制空腹血糖长达一天(图3b)。其中,口服胶束胶囊能够维持正常血糖状态达10小时,且在此过程中未观察到低血糖情况(图3c)。与之对比,皮下注射的甘精胰岛素则会导致治疗小鼠出现约3.2小时的低血糖(小于50 mg/dl)。值得注意的是,该文章所报道的口服制剂在小鼠体内未导致明显的毒性作用和促炎作用,因此具有较高的生物相容性。
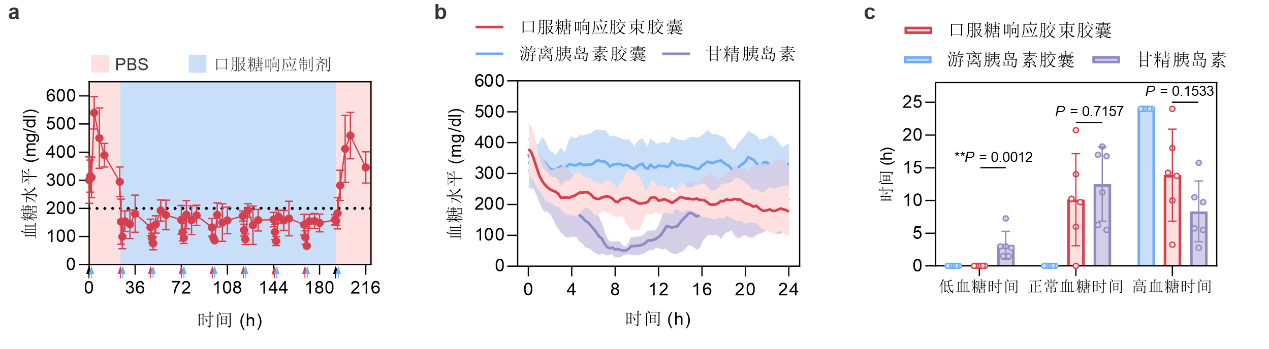
图3:a,糖尿病小鼠在连续给予口服制剂后的血糖水平变化(蓝色箭头表示食物供给,红色箭头表示口服糖响应制剂灌胃,黑色箭头表示pbs灌胃)。b,糖尿病小猪口服制剂胶囊后的血糖水平变化。c,糖尿病小猪在治疗后,低血糖、正常血糖和高血糖状态的持续时间。
这一血糖响应性胰岛素口服制剂可显著提升胰岛素给药的便捷性、有效性和安全性,为口服胰岛素制剂的临床转化提供了创新策略与理论支撑。(来源:科学网)
相关论文信息: