8月18日,国际学术期刊cell reports medicine在线发表了中国科学院分子细胞科学卓越创新中心高栋研究组、陈洛南研究组、杨巍维研究组与海军军医大学第一附属医院(上海长海医院)金钢研究组、中国科学院上海营养与健康研究所尹慧勇研究组的合作研究成果: metabolic classification suggests glut1/aldob/g6pd axis as a therapeutic target in chemotherapy-resistant pancreatic cancer。该研究系统性揭示胰腺导管腺癌(pdac)的代谢组学特征,并通过整合代谢组、全基因组、转录组和药物敏感性等多组学数据提出不同代谢亚型的化疗敏感性机制及潜在治疗靶点。
pdac 5年生存率为11%,是最恶性的实体肿瘤。化疗可以显著延长pdac患者的生存期,但由于复杂且不明确的耐药机制,pdac患者的化疗反应率仍然很低。基于基因组和转录组特征的分型未能对pdac的化疗敏感性或临床治疗提供指导,目前pdac仍然被当作单一类型的肿瘤进行治疗。肿瘤代谢重编程被认为是一种新兴的治疗抵抗机制,然而pdac中丰富的间质细胞使得捕获肿瘤特异性代谢信息变得困难。患者来源的肿瘤类器官作为一种新型研究模型,在再现原发肿瘤的特征方面已被证明优于传统细胞系。利用类器官模型深入探索胰腺癌代谢组学特征,并整合分析多组学数据,揭示胰腺癌在代谢层面的差异及潜在药物靶点具有重要科学价值和临床应用前景。
研究团队以28例胰腺癌类器官为模型,系统性收集了代谢组学、全基因组学、转录组学、染色质开放性以及药物敏感性信息。利用代谢组学对pdac进行分型,鉴定了2种代谢亚型,分别富集糖代谢(glucomet-pdac)和脂代谢(lipomet-pdac)。与lipomet-pdac相比,glucomet-pdac对化疗更抵抗,同时具有glucomet-pdac特征的病人预后更差。进一步整合多组学发现,glut1/aldob/g6pd代谢轴在glucomet-pdac代谢重编程过程中发挥重要作用。首先,在glucomet-pdac中,glut1高表达,转运更多的葡萄糖进入肿瘤细胞。其次,aldob表达的降低释放了g6pd的活性,提高了氧化型戊糖磷酸途径的代谢通量。氧化型戊糖磷酸途径代谢通量的增加在glucomet-pdac中合成了更多参与dna合成原料,诱导了其对化疗药物的耐药性。在glucomet-pdac中敲低glut1、过表达aldob或者敲低g6pd都可以导致细胞对化疗药物敏感性的增加。同样,glut1和g6pd的抑制剂在体内外都可增加pdac对化疗药物的敏感性。最后,通过虚拟筛选及体内外验证,发现aurora的两个临床抑制剂mln8054及alisertib可以有效抑制g6pd的活性并增加化疗药物的敏感性。该研究揭示了与pdac化疗敏感性相关的潜在代谢异质性,并通过化疗和glut1/aldob/g6pd轴抑制剂的组合为化疗耐药性glucomet-pdac患者开发了一种有希望的药理学策略。
分子细胞卓越中心高栋研究员、陈洛南研究员、杨巍维研究员以及营养与健康所尹慧勇研究员、上海长海医院肝胆胰脾外科金钢教授为该论文共同通讯作者。分子细胞卓越中心李允广博士后、唐诗婕博士后、吴雪媛博士研究生、张晔晗博士研究生、上海长海医院肝胆胰脾外科时霄寒,以及营养与健康所吕静雯博士研究生为该论文共同第一作者。该项研究工作得到国家重点研发计划项目、国家自然科学基金、中国科学院战略性先导科技专项、上海市科学技术委员会等资助。该项研究工作得到了分子细胞卓越中心细胞分析技术平台、化学生物学技术平台和动物实验技术平台的支持。(来源:中国科学院分子细胞科学卓越创新中心)
相关论文信息:
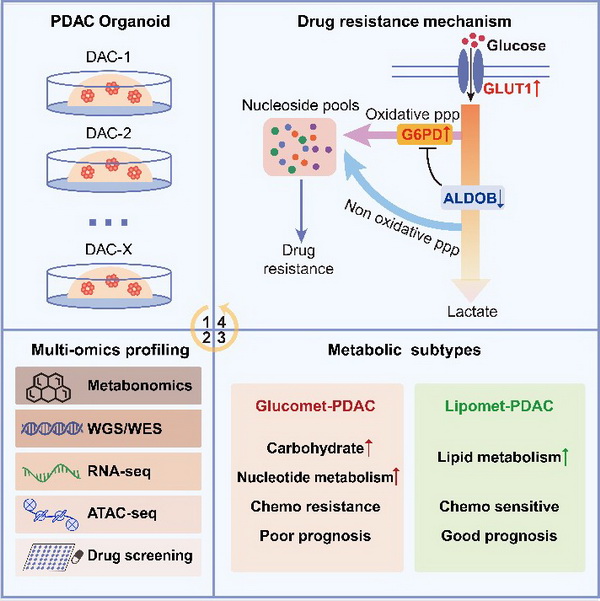
胰腺癌代谢分型及其重编程诱导的耐药模式图
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负米乐app官网下载的版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。