药物分子中氢原子转换成氘原子不影响其作用靶标,但能有效延长在体内的半衰期和减少有毒代谢产物的生成。苯环是药物分子中一种广泛存在的结构,由于苯环的化学反应惰性,通过常规碳氢键断裂或氧化的策略无法实现氢氘的直接交换。云南大学夏成峰研究团队提出利用可见光诱导产生的高活性溶剂化电子还原活化芳烃,通过阻断birch还原策略实现药物分子中苯环上氢氘的直接交换。相关成果“deuteration of arenes in pharmaceuticals via photoinduced solvated electrons”发表在2024年7月18日的chem期刊上。论文通讯作者为夏成峰教授和梁康江副研究员,硕士生陶轶和金翠花为共同第一作者。
氘作为氢的一种稳定非放射性的同位素,由于碳−氘键相比于碳-氢键具有更低的振动频率和零点能,两者在化学反应中表现出明显的动力学同位素效应。利用该特性将药物分子中特定位点的氢原子用氘原子替代,在不改变药物分子结构、性质和作用靶标的情况下,可以起到改善药物药代动力学和/或降低药物毒性的作用,受到了医药行业的高度重视(图1)。2017年美国食品药品监督管理局批准了全球首个氘代药物氘代丁苯那嗪片,2021年多纳非尼作为多激酶抑制剂在中国获批上市。
目前药物分子氘代标记主要有两种策略,传统方法一般从可商业获得的氘代原料开始,通过多步合成策略得到目标氘代药物,此策略需要对药物的制备工艺进行重新开发,成本相对较高,且受氘代原料的限制。而采用氢氘交换策略,利用现有药物制备工艺在合成后期直接实现药物分子的氘代,此类方法由于其经济性和实用性越来越受到关注。近年来,可见光反应策略在药物分子中c(sp3)–h键氘代标记的研究方面取得了重要进展。但由于芳烃化合物中c(sp2)–h键的高键离解能,同时由于芳烃的氧化还原惰性,常规的电子转移和原子转移策略无法实现此类化合物的活化。

图1:药物分子氘代标记的方法。
在该研究中,作者以右美沙芬作为模型底物,利用团队前期开发的一类具有超强还原能力的酚类光催化剂dbpp,在可见光照射下产生溶剂化电子,将苯环还原生成自由基负离子后引入氘原子,然后通过阻断birch还原策略,成功实现芳烃药物分子中c(sp2)–h键的直接氘代反应(图2)。采用该可见光诱导氘氢直接交换方法,作者完成了25种临床含苯环、萘环以及杂环芳烃药物的氘代反应,在复杂底物中展现出良好的官能团耐受性和化学选择性。该研究成功开发了一种反应条件温和、氧化还原中性、无过渡金属参与的芳烃c(sp2)–h键氘代新方法,反应无需底物预活化以及定位官能团的参与,可适用于各种复杂药物分子的直接氘代反应,为氘代药物的合成提供一种高效方法。
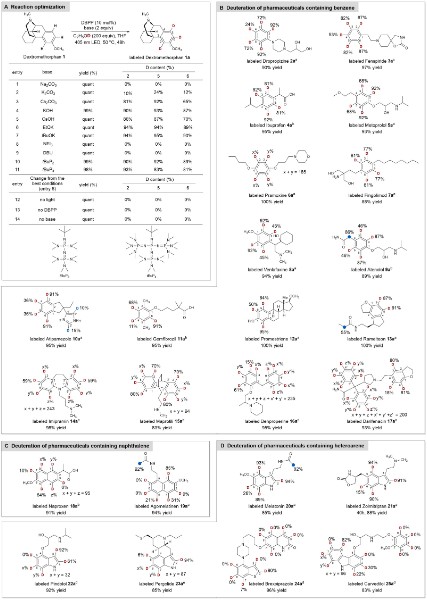
图2:反应条件优化与合成应用。
为了验证反应机理,作者通过纳秒瞬态吸收光谱中的红光区宽吸收带证实了反应体系中溶剂化电子的形成,并利用硝酸盐作为溶剂化电子猝灭剂,进一步证实了此信号为溶剂化电子的生成(图3)。同时以3,4–(亚甲二氧基)甲苯作为反应底物,通过形成的开环产物证明反应过程涉及苯自由基负离子中间体。作者还探讨了氘代环己二烯基自由基的芳构化过程,阐明了在碱性条件下环己二烯基自由基去质子化后生成具有强还原性的苯基自由基负离子,通过与酚氧自由基dbpp˙发生单电子转移反应生成目标氘代产物,同时实现催化剂的再生。
图3:反应机理研究。
(来源:科学网)
相关论文信息: