过继t细胞转移(adoptive t-cell transfer,act)疗法是极具前景的肿瘤免疫疗法,但对实体瘤效果欠佳,亟需通过学科交叉来发展针对实体瘤增效的新理念和新技术。
2023年5月15日,浙江大学药学院平渊团队联合中国科学院过程工程所生化工程国家重点实验室魏炜团队在nature nanotechnology期刊发表了一篇题为“non-invasive activation of intratumoural gene editing for improved adoptive t-cell therapy in solid tumours”的研究论文,开发了一种非侵入性基因编辑技术,可以通过非侵入手段(近红外光或聚焦超声)激活实体瘤的凋亡抵抗基因编辑,并同时调控实体瘤物理和免疫微环境,显著提升了多种act疗法对实体瘤的疗效。
浙江大学药学院陈小红博士、中国科学院过程工程所王双副研究员、浙江大学药学院博士生陈宇轩为该论文共同第一作者,浙江大学药学院平渊教授、中国科学院过程工程所魏炜研究员为共同通讯作者。
目前,癌症是全球范围内最常见的致死性疾病之一。传统的癌症治疗方法包括手术、放射和化学治疗等,但这些方法都存在着一定的局限性。例如,手术可能无法完全切除肿瘤组织;放射和化学治疗可能会对健康细胞造成损伤。近年来,过继性t细胞(adoptive t-cell transfer,act)免疫治疗和基因组编辑(genome editing)治疗成为了癌症治疗领域的新兴方向。然而,细胞免疫治疗的效果受到肿瘤细胞凋亡抵抗机制和肿瘤微环境的影响,而基因编辑技术则需要通过递送crispr/cas9来实现基因组编辑,这也存在着一定的局限性。
有鉴于此,浙江大学药学院平渊团队联合中国科学院过程工程所魏炜团队开发了一种非侵入性基因编辑技术,可以通过非侵入手段(近红外光或聚焦超声)激活实体瘤的凋亡抵抗基因编辑,并同时调控实体瘤物理和免疫微环境,显著提升了多种act疗法对实体瘤的疗效。
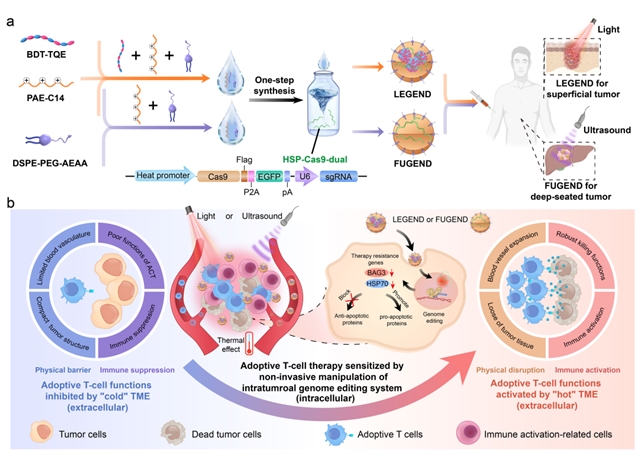
图1:光/声非侵入手段激活瘤内基因编辑增效act疗法的作用机制。
act疗法通过获取患者自身t细胞进行体外改造,使其回输患者体内后识别并攻击肿瘤细胞。然而,由于实体瘤细胞内的凋亡抵抗作用保护其免于t细胞的杀伤,以及实体瘤细胞外的致密物理屏障、免疫抑制屏障等微环境限制了t细胞向实体瘤深处的浸润及杀伤功能的发挥,导致了act疗法对大多数实体瘤疗效不佳。
面对以上诸多挑战,平渊教授团队基于多年基因编辑递送及调控的研究经验,与魏炜研究员团队基于在肿瘤免疫治疗及生物剂型工程深厚的研究基础,展开交叉合作研究。双方在多维度协同改善细胞内凋亡抵抗和细胞外微环境的新理念基础上,提出利用近红外光照射nir或聚焦超声fus非侵入性策略带来的温热效应,激活基因编辑敲除肿瘤细胞抗凋亡基因(hsp70和bag3),并同时打破实体瘤的物理屏障和免疫抑制屏障。通过上述协同作用,在动物肿瘤模型上显著增强了t细胞的瘤内浸润和对肿瘤细胞的杀伤效果。
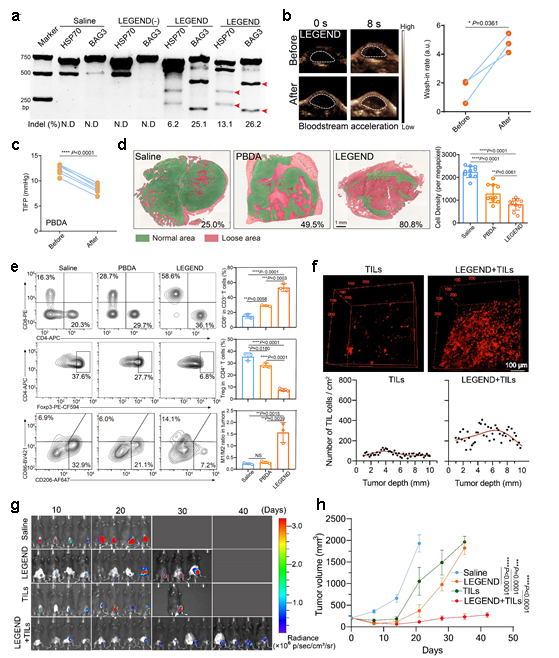
图2. legend体系多维度协同改善细胞内凋亡抗性和细胞外微环境,提升til疗法治疗效果。a. legend nir照射激活瘤内基因编辑,敲除肿瘤细胞抗凋亡基因(hsp70和bag3);b-d. nir温热效应打破实体瘤的物理屏障,包括血流加速(b)、间质压力降低(c)、组织疏松(d);e. nir温热效应改善肿瘤免疫抑制微环境;f. legend处理后显著增强til的瘤内浸润;g,h legend处理后显著提升til回输疗法的抑瘤效果。
其中,针对浅表肿瘤,研究团队发展了光驱动型基因编辑纳米器件(legend),采用“纳米器件瘤周注射 nir照射”的方式,在黑色素瘤等小鼠肿瘤模型以及人源化的患者来源肿瘤异种移植模型上显著提升了肿瘤浸润t细胞和嵌合抗原受体t细胞两种过继回输t细胞疗法的治疗效果。针对深部腔内肿瘤,研究团队进一步发展了聚焦超声驱动型基因编辑纳米器件(fugend),采用“纳米器件静脉注射 fus”的方式,在小鼠原位肝癌模型上同样证明了显著的act增效作用。
据研究人员介绍,上述成果仍属于临床前研究,实际临床疗效仍有待进一步验证。鉴于该体系构建的通用性和灵活性,未来临床转化时可以按照不同治疗需求采用不同的基因编辑策略及非侵入操控方式。
近三年来,浙江大学药学院平渊教授开发了多种非病毒载体在基因编辑工具的递送,在动物模型上成功用于肿瘤、炎症性疾病的治疗。相关工作相继发表于pnas. 2020, 117, 2395-2405、sci. adv. 2021, 7, eabj0624、sci. adv. 2021, 7, eabe2888、adv. mater. 2021, 2006003、acs cent. sci. 2021, 7, 990-1000、nano lett. 2021, 21, 9761-9771、signal transduct. target. ther. 2022, 7, 269及sci. adv. 2022, 8, abp9435等期刊上。
近五年来,中国科学院过程工程所生化工程国家重点实验室马光辉院士团队魏炜研究员创制了一系列药物和疫苗递送新剂型,在动物模型上成功用于肿瘤、传染病、炎症性疾病的防治,并且部分剂型已通过医院伦理批准进入个体化临床前和临床研究。相关工作相继发表于nat nanotechnol 2021, 16, 1413、sci transl med 2021, 13, eabb6981、nat biomed eng 2023, accepted、nat biomed eng 2021, 5, 414、nat biomed eng 2021, 5, 968、sci adv 2021, 7, eabd7614、sci adv 2021, 7, eaba2458、sci adv 2020, 6, eaay7735、sci adv 2019, 5, eaaw3192、nat commun 2022, 13, 4214、nat commun 2021, 12, 6399、nat commun 2019, 10, 5165、nat commun 2017, 8, 14537等期刊上。
该工作得到了国家重点研发计划项目、国家自然科学基金项目和浙江省自然科学基金的支持。(来源:科学网)
相关论文信息: