|
|
|
|
|
新型纳米载体共载铂类和xkr8sirna改善肿瘤微环境 |
|
|
北京时间2022年11月25日,美国匹兹堡大学药学院的黎松教授和哈肯萨克医疗中心的卢斌峰教授联合在nature nanotechnology期刊发表了一篇题为“targeting xkr8 via nanoparticle-mediated in situ co-delivery of sirna and chemotherapy drugs for cancer immunochemotherapy”的研究成果。
作者发现肿瘤细胞中的xkr8在铂类药物治疗后呈显著高表达,进而研发了一种能共载铂类药物和xkr8sirna的新型纳米载体。该载体在体内能高效靶向肿瘤细胞、阻断ps外翻。
论文通讯作者是黎松、卢斌峰;第一作者是陈与昂、黄逸先。
磷脂酰丝氨酸(ps)是一类普遍存在于哺乳动物细胞中的磷脂,作为膜结构的重要组成部分,通常分布于细胞膜内侧。在癌症治疗过程中,常规放化疗会使ps在肿瘤细胞凋亡时被促翻转酶(scramblase)xkr8不可逆地外翻。外翻的ps会与免疫细胞上的受体结合,引起严重的免疫抑制,致使肿瘤治疗效果不甚理想。因此,抑制xkr8可成为改善肿瘤微环境以达到更好治疗效果的一种新途径。
作者发现经过铂类药物治疗后,小鼠肿瘤中xkr8的转录和蛋白水平均显著上升。由于目前缺乏有效针对xkr8的小分子拮抗剂和单抗,他们希望通过同时递送药物和sirna的方式来抑制凋亡肿瘤细胞中产生和活化的xkr8。为此,他们研发了一种纳米聚合物pmbop,其脂质链能帮助铂类药物(fuoxp)更有效地载入疏水核中,并促进聚合物与细胞膜的融合。其阳离子双胍基团能和sirna形成离子相互作用,从而使sirna稳定地结合在聚合物表面。但表面带正电的聚合物不适用于静脉注射。于是,作者使用了带有大量负电的硫酸软骨素(cs)和聚乙二醇化的cs(peg-cs)包覆聚合物表面,形成了pmbop-cp纳米载体。值得注意的是,cs是cd44(在各类肿瘤细胞及肿瘤内皮细胞上有很高的表达)的一种重要天然配体。通过调节pmbop、cs和peg-cs的比例,不仅可以中和载体表面的正电荷,而且还能精准靶向肿瘤细胞。

作者通过大量体外、体内筛选,最终确定了载体各组成部分的最优比例,并发现小鼠肿瘤内的载体浓度高于肝脏约3倍。该载体不仅对超过5种不同类型的皮下肿瘤模型有靶向作用,在原位肿瘤和肺部转移灶中也有很高的累积。
接下来,作者在体外通过sirna抑制了肿瘤细胞的xkr8,从而明显降低了其表面ps的表达量。在与巨噬细胞的共培养实验中,他们发现抑制肿瘤细胞的xkr8可以诱导巨噬细胞向m1群体的分化,对其免疫抑制类细胞因子(如il-10)的分泌也具备明显的阻断作用。
最后,作者分别对小鼠结肠癌和胰腺癌的模型进行了抗肿瘤研究。他们发现利用载体同时递送铂类药物和xkr8 sirna,相较于单个递送,既能明显减缓小鼠肿瘤的生长速度,又能显著改善肿瘤微环境,大幅增加淋巴细胞、功能性t细胞、m1型巨噬细胞等抗肿瘤免疫细胞的浸润。
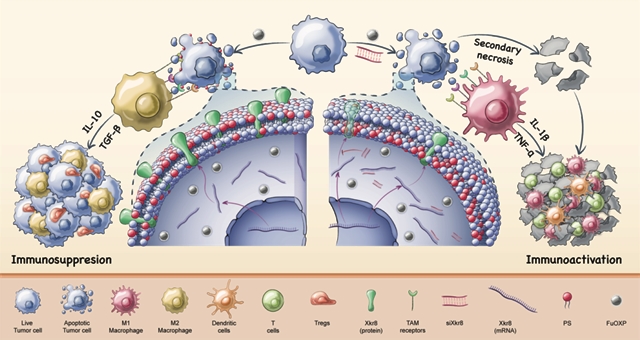
综上所述,该研究发现铂类药物能显著诱导肿瘤细胞中转录和蛋白水平的 xkr8表达。作者继而研发了一种基于 pmbop-cp 的纳米载体。首先,该载体具备极高的肿瘤特异性,可以通过肿瘤及肿瘤内皮细胞上cd44介导的主动靶向,最大限度地增加肿瘤组织摄取并减少肝脏摄取。其次,该载体通过同时递送药物和sirna,在有效减缓肿瘤生长的同时,针对性地增强了抗肿瘤免疫反应,从而达到一加一大于二的叠加效果。此外,有文献报道将普通小鼠体内的xkr8完全敲除不会诱发其产生自身免疫疾病,在体内抑制 xkr8将是一种安全可靠的方法。因此,将铂类药物与靶向xkr8技术相结合的方式预示着癌症免疫治疗的新方向。(来源:科学网)
相关论文信息: