论文标题:
期刊:
作者:wencheng zhang, yangyang cui, yuan du, yong yang, ting fang, fengfeng lu, weixia kong, canjun xiao, jun shi, lola m. reid, zhiying he
发表时间:15 jun 2023
doi:
微信链接:
导 读 肝脏拥有复杂的细胞组成和强大的再生能力,其功能的实现依赖于肝细胞和胆管细胞等实质细胞与非实质细胞的相互作用。近年来,基因测序技术和细胞移植策略的突破为终末期肝病治疗带来了新希望。
同济大学生命科学与技术学院何志颖和北卡罗来纳大学教堂山分校医学院lola m. reid等在frontiers of medicine发表综述《肝脏细胞治疗:细胞来源和移植策略》(liver cell therapies: cellular sources and grafting strategies), 研究探讨肝脏稳态的细胞机制,并介绍选择理想的细胞来源和移植策略以实现肝脏再生和修复的最新进展。
肝脏是解毒、代谢、糖原和脂质储存与调节,以及分泌全身所需各种因子等功能的关键器官,其功能的实现依赖于肝细胞、胆管细胞等多种细胞的协同作用。肝脏拥有强大的再生能力,能够在正常细胞更新时维持功能,并能够在受到损伤后进行修复。肝脏的再生机制涉及多种细胞类型,包括胆管树中的干细胞/祖细胞——它们能够分化成肝细胞和胆管细胞,并形成肝脏细胞板。近年来,随着单细胞转录分析等技术的发展,对肝脏再生机制的理解更加深入,这为开发治疗终末期肝病的细胞疗法提供了新的思路。同济大学生命科学与技术学院何志颖和北卡罗来纳大学教堂山分校医学院lola m. reid等系统总结了在各种条件下参与肝脏修复的细胞特性的最新研究进展,以期提供有效干预终末期肝病的策略。
本文总结了肝脏再生中干细胞研究的最新进展与挑战。从“steaming liver”模型到肝脏发育谱系系统的认识深化,揭示了干细胞在肝脏稳态和损伤修复中的关键作用。研究确认了赫林管干细胞、肝祖细胞、lgr5 肝干细胞及axin2 肝细胞等多种干细胞群体的存在及其功能(图1)。此外,还探讨了胆管树中干细胞亚群,包括btscs及其亚群、肝/胰腺干细胞和十二指肠黏膜下腺体的干细胞,在肝脏再生中的潜力(图2)。通过谱系追踪技术,如crispr-cas9和protracer,科学家们能够追踪细胞增殖和分化过程,但仍需解决不同细胞群体功能机制不清及细胞移植策略优化等挑战。总体而言,肝脏再生机制的研究正逐步揭示其复杂性,为临床治疗提供了新的视角和可能性。
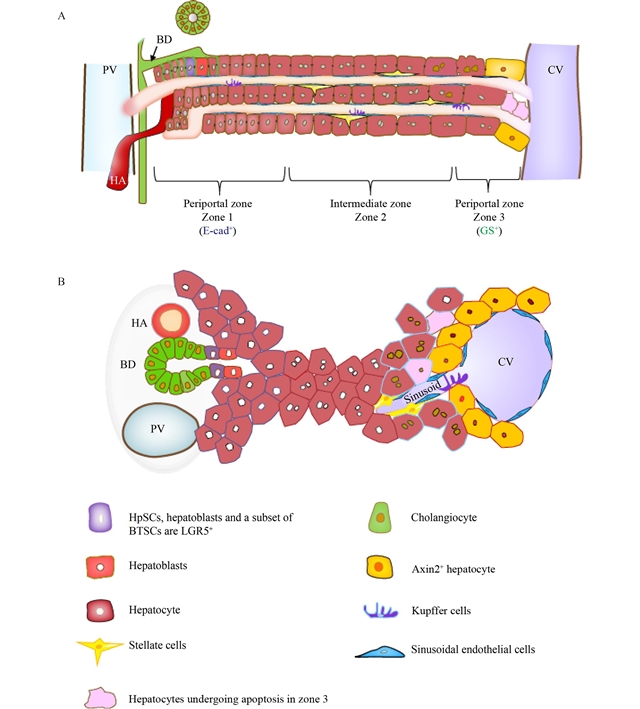
图1 肝脏细胞疗法的肝内细胞来源。
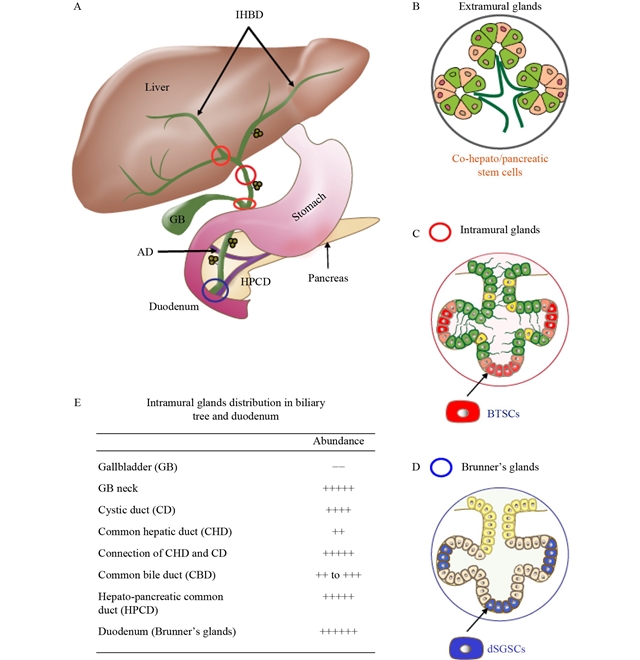
图2 肝细胞疗法的肝外干细胞/祖细胞来源。
干细胞(包括肝细胞)在肝病临床应用中展现出复杂而多样的潜力。在急性肝损伤时,肝细胞通过分裂和凋亡维持肝脏稳态,但慢性病理过程中肝细胞的持续凋亡和坏死超过了肝脏再生能力的上限,导致纤维化和肝硬化。肝细胞移植虽已尝试用于终末期肝病治疗,但受限于细胞增殖能力、植入效率低及副作用。因此,研究转向干细胞疗法,特别是间充质干细胞(mscs),其易于获取、保存和输送,主要通过旁分泌信号传送和免疫调节发挥作用,已在临床试验中显示改善肝功能的效果。此外,人多能干细胞和胆管树干细胞(hpscs和btscs)作为多能干细胞库,具有扩增潜力和分化为功能性肝细胞的能力,成为未来临床应用的希望。多能干细胞(pscs)如胚胎干细胞(escs)和诱导性多能干细胞(ipscs)也在探索中,但面临伦理、效率及安全性挑战。重编程成纤维细胞或肝细胞为肝细胞样细胞,以及构建肝脏类器官,为肝病治疗提供了新的策略和工具,尽管这些技术仍需进一步验证和优化以应用于临床。
本文介绍了将细胞递送到实体器官(特别是肝脏)的四种主要策略及其相关机制与挑战。首先,细胞移植和移植策略部分讨论了传统方法如直接注射和血管输注的局限性,以及新兴的贴片移植技术,该技术通过制备干细胞/祖细胞类器官并将其嵌入透明质酸水凝胶中,提高了移植效率和安全性。其次,生物材料在干细胞移植到肝脏中的应用,特别是透明质酸(ha)的使用,尤为关键,其物理化学性质和细胞生物学功能有助于优化移植过程。第三,细胞植入/植入机制部分揭示了肝细胞与肝窦内皮细胞(lsec)之间的相互作用,以及lsec在肝细胞移植和肝脏再生中的重要作用(图3)。最后,患病肝脏细胞移植的挑战部分探讨了纤维化和炎症性肝脏微环境对移植效果的影响(图4),并强调了改善肝脏微环境的重要性,包括治疗肝星状细胞(hscs)以防止hscs转化为肌成纤维细胞,或在移植前用巨噬细胞治疗纤维化患者以改善肝脏微环境,以提高干细胞移植的成功率。
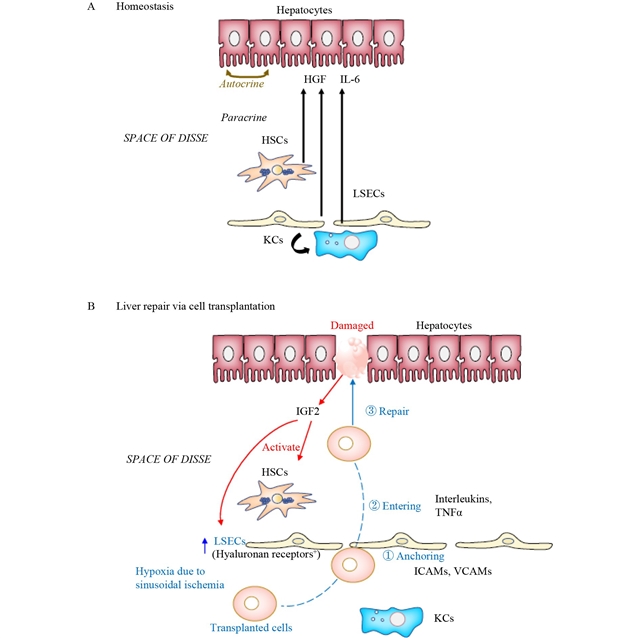
图3 通过血管输送进行细胞移植后的稳态维持和细胞修复。
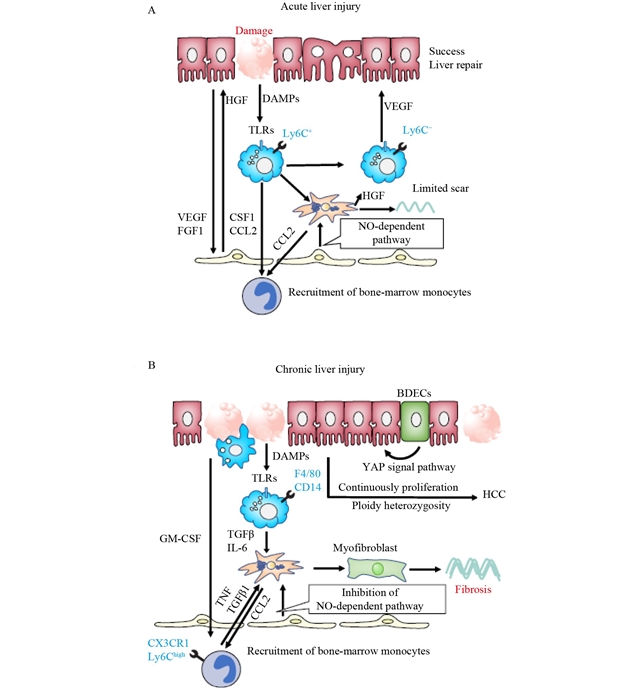
图4 急慢性肝损伤的细胞修复及其调控机制。
本文总结了不同生理与病理状态下细胞事件对肝衰竭治疗的重要性,并展望了细胞移植策略在纠正肝脏疾病状态方面的潜力,旨在克服全肝移植供体稀缺的问题。文章评估了多种候选细胞,指出多能干细胞主要用于非临床领域,间充质干细胞因转化限制而非最优选择,而肝脏内特定干细胞亚群,尤其是胆管树中的亚群,具有最大临床潜力。同时,讨论了现有细胞递送方法的不足及新型移植方法的前景,强调了移植过程需考虑肝脏纤维化环境的挑战。此外,还提及了免疫微环境对移植效果的影响,特别是巨噬细胞在减少肝脏瘢痕形成中的作用,为优化移植条件提供了新视角。最后,文章总结了肝脏分区研究在预测细胞群分区特征方面的进展,为肝脏再生研究提供了有力工具。
期刊介绍 frontiers of medicine专注于发表临床医学和基础医学领域的最新研究成果,旨在通过全球医疗专业人员之间的交流促进健康和医疗保健的发展。该刊采用严格的同行评审和编辑流程,确保发表的文章的科学准确性、新颖性和重要性。
原文信息
标题
liver cell therapies: cellular sources and grafting strategies
作者
wencheng zhang, yangyang cui, yuan du, yong yang, ting fang, fengfeng lu, weixia kong, canjun xiao, jun shi, lola m. reid, zhiying he
机构
1. institute for regenerative medicine, ji’an hospital, shanghai east hospital, school of life sciences and technology, tongji university, shanghai 200123, china
2. shanghai engineering research center of stem cells translational medicine, shanghai 200335, china
3. shanghai institute of stem cell research and clinical translation, shanghai 200120, china
4. postgraduate training base of shanghai east hospital, jinzhou medical university, jinzhou 121001, china
5. the first affiliated hospital of nanchang university, nanchang 330006, china
6. graduate school of frontier biosciences, osaka university, suita, osaka, 565-0871, japan
7. department of general surgery, ji’an hospital, shanghai east hospital, school of medicine, tongji university, ji’an 343006, china
8. department of cell biology and physiology and program in molecular biology and biotechnology; unc school of medicine, chapel hill, nc 27599, usa
通讯作者 lola m. reid, zhiying he
引用这篇文章
wencheng zhang, yangyang cui, yuan du, yong yang, ting fang, fengfeng lu, weixia kong, canjun xiao, jun shi, lola m. reid, zhiying he. liver cell therapies: cellular sources and grafting strategies. front. med. 2023;17(3): 432–457
感谢作者对frontiers of medicine的信任和支持。

《前沿》系列英文学术期刊
由教育部主管、高等教育出版社主办的《前沿》(frontiers)系列英文学术期刊,于2006年正式创刊,以网络版和印刷版向全球发行。系列期刊包括基础科学、生命科学、工程技术和人文社会科学四个主题,是我国覆盖学科最广泛的英文学术期刊群,其中12种被sci收录,其他也被a&hci、ei、medline或相应学科国际权威检索系统收录,具有一定的国际学术影响力。系列期刊采用在线优先出版方式,保证文章以最快速度发表。
中国学术前沿期刊网

特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负米乐app官网下载的版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。