北京时间2022年1月28日0时,西南交通大学的鲁雄教授、谢超鸣副教授团队、电子科技大学潘泰松副教授、中国海洋大学韩璐教授和北京基础医学研究所江小霞副研究员合作在matter上发表了一篇题为“bioadhesive and conductive hydrogel-integrated brain-machine interfaces for conformal and immune-evasive contact with brain tissue”的研究。
团队通过在柔性水凝胶网络中引入双键化多巴胺限域聚合的导电高分子纳米颗粒,成功制备了具有组织粘附性及超软力学性能的导电水凝胶,并将其与微尺度电极集成,构建了一种基于水凝胶的柔性脑机接口(brain-machine interface,bmi)。该水凝胶bmi能够克服与脑组织的力学和生物学性能的不匹配性,实现体内炎症水平下的免疫逃逸,有望作为植入式bmi长期监测脑电信号。论文通讯作者是鲁雄、谢超鸣、潘泰松、韩璐、江小霞;第一作者是王笑、孙晓彤。
bmi可用于监测大脑的功能,并对一些神经性疾病进行诊断和治疗。但是,由于脑组织具有弹性和灵活性,因此与常规刚性电子元件耦合的界面会产生产生机械失配的问题,从而造成排异反应(foreign body response,fbr)不仅会损伤组织,还会削弱信号的传递,从而缩短bmi服役寿命。水凝胶是一类含水量高的三维网状材料具有与软组织类似的结构。通过分子设计,水凝胶可达到与脑组织接近的力学性能及生物学性能,有望解决刚性电子元件和柔软脑组织之间的机械和化学不匹配的难题。
近日,西南交通大学的鲁雄教授、谢超鸣副教授团队、电子科技大学潘泰松副教授团队、中国海洋大学韩璐教授和北京基础医学研究所江小霞副研究员合作研发了一种基于双键化多巴胺限域聚合的亲水且导电的3,4-乙烯二氧噻吩纳米颗粒(dpedot nps),并将其引入到卡拉胶(ca)-聚多巴胺(pda)-聚丙烯酰胺(pam)互穿水凝胶网络中,最终形成了具有超软、组织粘附和免疫逃逸性能的导电水凝胶(dpedot-ca-pda-pam)。并提出以该多功能水凝胶作为柔性导电界面,实现刚性微电路和柔软脑组织的无缝联接。由于水凝胶可通过原位自固化,能够在保持电路完整性的同时,实现微电路的转印,最终集成水凝胶基bmi。该水凝胶bmi可以与脑组织形成极好的力学性能匹配,且可以紧密贴合于大脑皮层,减轻组织与bmi之间因摩擦而导致的fbr;同时,其具有主动免疫逃逸能力,能够抑制神经炎症,提高了bmi的生理稳定性,有助于实现bmi长期的脑电信号记录(图1)。
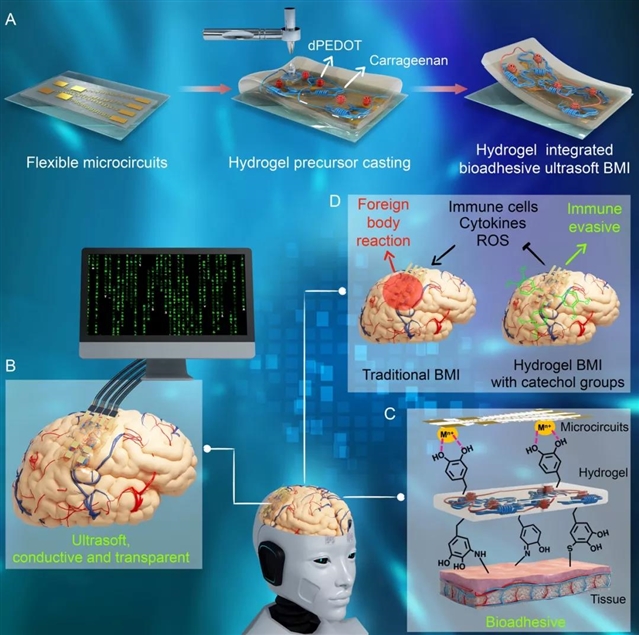
图1:(a)水凝胶原位转印电路构建bmi的示意图;水凝胶bmi展现出(b)超软、导电、透明及(c)组织粘附的特性;(d)水凝胶bmi可通过免疫逃逸来减小体内免疫排斥反应。
1、水凝胶具有超低模量和良好的组织粘附性,与脑组织可力学匹配。dpedot nps在水凝胶网络中构建了一个动态氧化还原系统,能够维持水凝胶中儿茶酚氧化还原平衡,从而赋予水凝胶与脑组织相似的模量(小于1 kpa)及良好的组织粘附性(图2)。水凝胶的粘附性保证了其能够与金属微电路紧密集成,同时也保证了水凝胶bmi与脑组织的无缝贴合,从而实现信号稳定传输。此外,通过he染色和动物饮食行为、情绪评估证实植入式水凝胶bmi具有良好的生物相容性,不会对脑组织造成损伤,并在植入后可被无损取出(图3)。
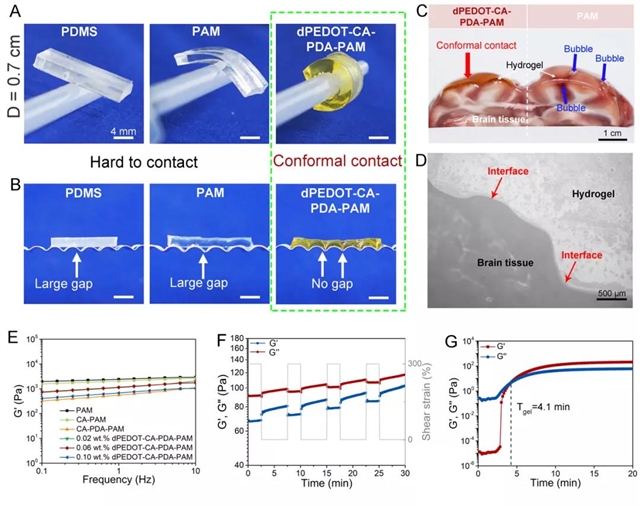
图2:dpedot-ca-pda-pam水凝胶的组织粘附和超软特性。(a)厚度为3 mm的水凝胶可紧密缠绕在直径为0.7 cm柱状体表面;(b)水凝胶可无缝贴合在褶皱的表面;(c)水凝胶可在新鲜脑组织无缝贴合;(d)水凝胶-脑组织界面的显微镜图片,显示界面结合紧密;(e)通过调控水凝胶中dpedot nps的含量为0.1 wt.%时,水凝胶可达到与脑组织相似的模量(~0.5 kpa);(f)交替步进应变扫描测试表明水凝胶网络(未加交联剂)具有良好的力学回复性;(g)水凝胶的自固化时间测试。
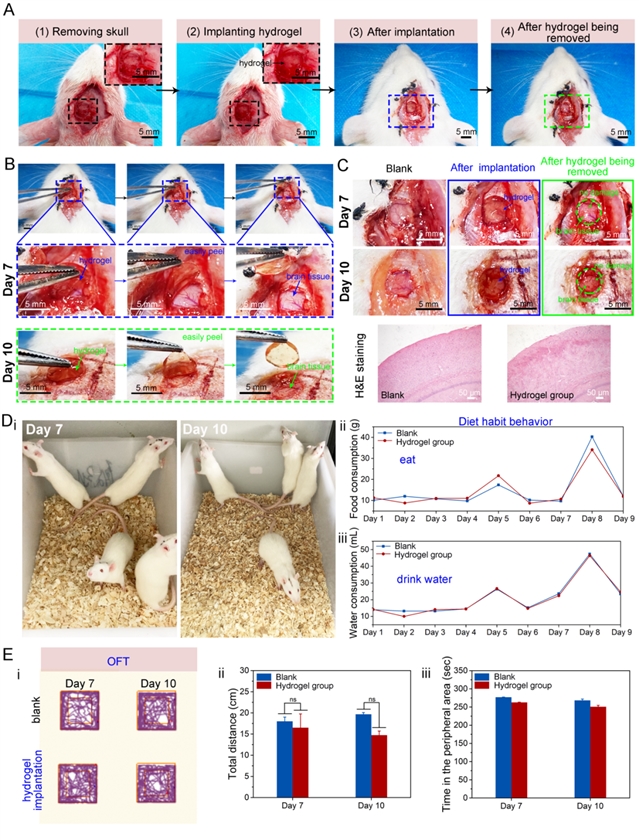
图3:(a)大鼠颅内植入、取出水凝胶过程;(b)水凝胶植入7天和10天后可从脑组织上无损取出;(c)植入10天后,脑组织切片的he染色表明水凝胶植入不会对脑组织造成损伤;对植入水凝胶的大鼠的(d)饮食行为、(e)焦虑情绪的评估,其与未手术组大鼠行为几乎没有差别。
2、该水凝胶具有主动免疫逃逸能力。dpedot-ca-pda-pam水凝胶具有降低神经炎症和抑制纤维组织增生的作用,避免fbr及纤维囊的形成(图4和5)。这主要归因于水凝胶中儿茶酚官能团优异的抗炎能力,从而使得水凝胶bmi能够长期、稳定、准确地记录脑部信号(图4和5)。

图4:dpedot-ca-pda-pam水凝胶的主动免疫逃逸行为。(a)pam水凝胶和(b)dpedot-ca-pda-pam水凝胶在大鼠皮下植入1天和2周,对水凝胶周围组织的fbr生物标志物免疫荧光染色图;(c)免疫荧光强度定量统计,dpedot-ca-pda-pam水凝胶具有显著降低炎症水平和抑制纤维组织增生的作用;(e)dpedot-ca-pda-pam水凝胶的免疫逃逸作用机制。
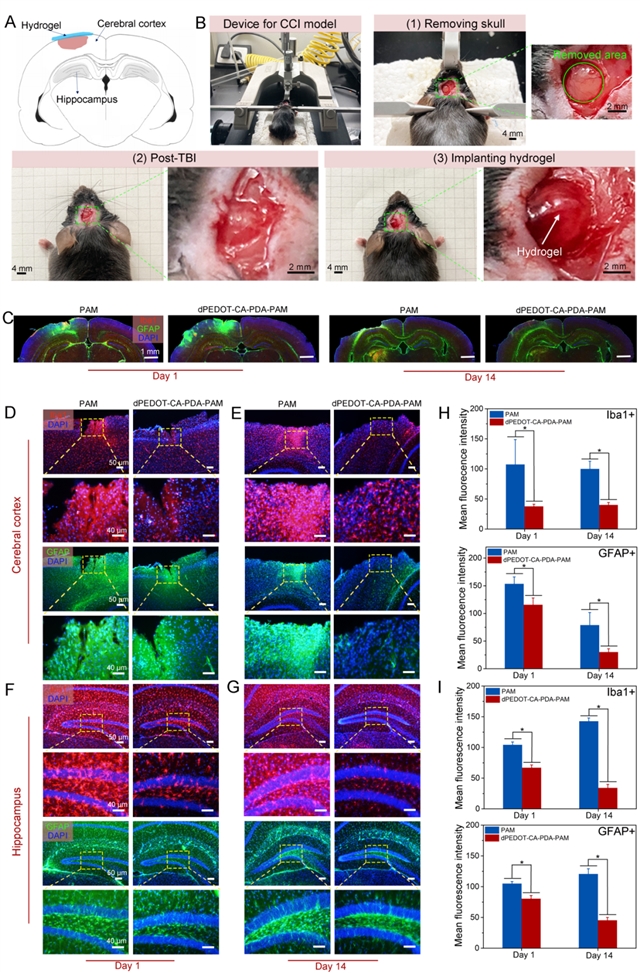
图5:轻度创伤性脑损伤(mtbi)模型评估水凝胶抑制神经炎症。(a)mtbi损伤区域示意图;(b)mtbi造模与水凝胶植入过程;(c)水凝胶植入1天、14天后,脑组织免疫荧光染色图;(d)在第1天和(e)第14天时,大脑皮层处星胶和小胶细胞标志物的免疫荧光图;(f)第1天和(g)第14天海马区星胶和小胶细胞标志物的免疫荧光图;(h)大脑皮层和(i)海马区的星胶和小胶标志物的免疫荧光统计分析。
基于以上优异性能,该组织粘附且超软的水凝胶基bmi可作为植入式bmi准确地记录颅内皮层脑电信号(ecog),也可作为可穿戴式电极采集头皮脑电信号(eeg),(图6和7)。该团队研发的水凝胶bmi制备操作简单且用完可无损移除,有望在诸多临床领域使用,例如,长时间监测癫痫持续状态的病人。
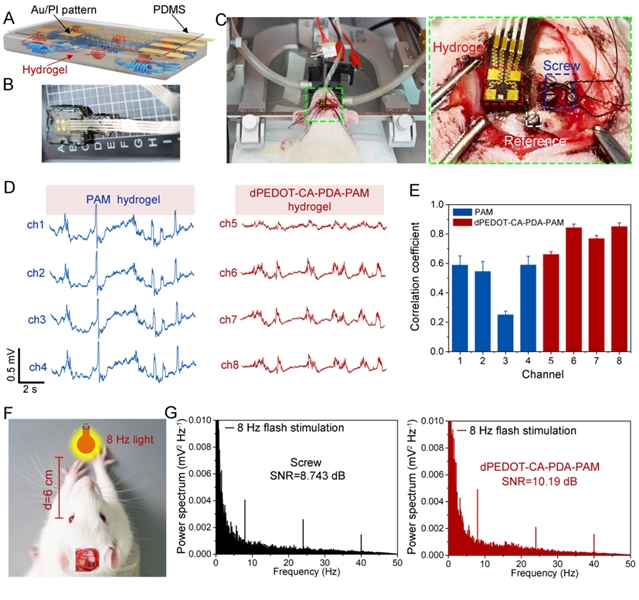
图6:超软水凝胶脑机接口无缝贴合在大脑皮层处用于监测颅内ecog信号。水凝胶集成的组织粘附、超软bmi的(a)示意图和(b)实物图;(c)组织粘附、超软bmi和商用螺钉电极的植入过程和植入位置;(d)由pam和dpedot-ca-pda-pam水凝胶bmi分别记录的ecog信号;(e)由pam和dpedot-ca-pda-pam水凝胶bmi分别记录的ecog信号与商用螺钉电极之间的相关系数;(f)稳态视觉诱发电势(ssvep)信号实验装置的示意图;(g)ssvep实验中,由螺钉电极(左)和dpedot-ca-pda-pam水凝胶bmi(右)收集的ecog信号的能量谱和相应的信噪比值(snr)。
图7:组织粘附、超软bmi用于大脑皮层eeg和眼电信号(eog)的记录。(a)水凝胶与柔性电路集成形成具有粘附性的水凝胶bmi。(ai)超软水凝胶bmi贴在头带上的实物图;(aii)所有电极的位置,位置#1,湿电极(ag/agcl)作为参考电极,位置#2,湿电极作为工作电极,位置#3,水凝胶电极作为工作电极,位置#4,干电极作为工作电极;(b)eog采集。(bi)眼睛的左右移动,(bii)有不同电极记录的eog信号;(c)eeg采集。(ci)由三种电极记录的人在苏醒和休息状态下的eeg信号,(cii)休息状态下eeg信号的傅里叶变换谱,红色圈代表安静且闭眼状态下,脑皮层脑电活动脑电图以α波为主。
(来源:科学网)
相关论文信息: